
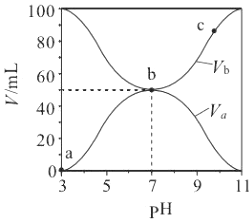
| A. | Ka(HA)的值与 Kb(BOH) 的值不相等 | |
| B. | b 点时,水电离出的 c(H+)=10-7mol/L | |
| C. | c 点时,c(A-)>c(B+) | |
| D. | a→c 过程中$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$不变 |
分析 根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;
A.酸碱恰好完全反应时溶液的pH=7,溶液呈中性,说明HA电离程度和BOH电离程度相同;
B.BA是弱酸弱碱盐,促进水电离;
C.c点溶液中溶质为BA和BOH,混合溶液的pH>7,说明BOH电离程度大于BA水解程度;
D.$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{1}{\frac{c(O{H}^{-}).c(HA)}{c({A}^{-})}}$=$\frac{1}{{K}_{h}}$,水解平衡常数只与温度有关.
解答 解:根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;
A.酸碱恰好完全反应时溶液的pH=7,溶液呈中性,说明HA电离程度和BOH电离程度相同,则Ka(HA)的值与 Kb(BOH) 的值相等,故A错误;
B.BA是弱酸弱碱盐,促进水电离,所以b点水电离出的 c(H+)>10-7mol/L,故B错误;
C.c点溶液中溶质为BA和BOH,混合溶液的pH>7,说明BOH电离程度大于BA水解程度,则c(A-)<c(B+),故C错误;
D.$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{1}{\frac{c(O{H}^{-}).c(HA)}{c({A}^{-})}}$=$\frac{1}{{K}_{h}}$,水解平衡常数只与温度有关,温度不变,水解平衡常数不变,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生图象分析及判断能力,明确各个数据含义及各点溶液中溶质成分及其性质是解本题关键,易错选项是B,b点溶液中的水电离出的 c(H+)>10-7mol/L,因为部分氢离子和酸根离子结合生成HA而导致 c(H+)=10-7mol/L.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
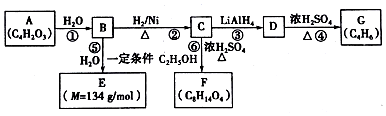
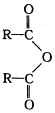 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)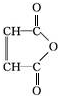 .
.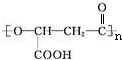 .有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.
.有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有2种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
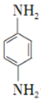
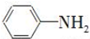 )有还原性,易被氧化;
)有还原性,易被氧化;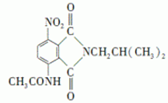 .
.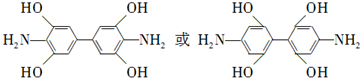 .
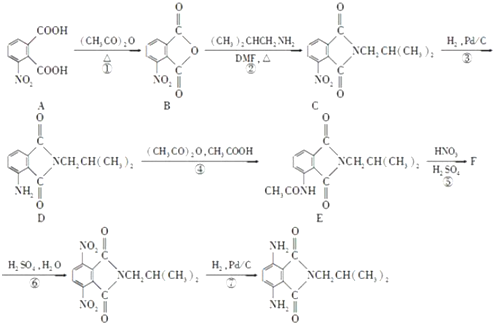
. 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
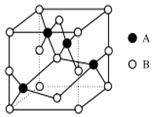 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:
纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2的化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
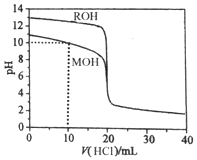
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
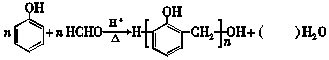
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下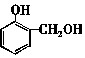 比 比 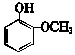 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是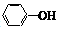 和HCHO 和HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的NaOH溶于1L水中形成溶液的物质的量浓度为lmol•L-1 | |
| B. | 总质量为18g的H216O和H218O所含分子数为NA | |
| C. | 常温常压下,22.4L的CO2与Mg完全反应,转移电子数为4NA | |
| D. | 硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=c(OH-) | B. | c(ClO-)+c(OH-)═c(Na+) | ||
| C. | c(OH-)═c(HClO)+c(H+) | D. | 2c(ClO-)+2c(HClO)═c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com