
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
【答案】酸式偏大溶液由无色变为紫红色且在半分钟内不褪色0.210KMnO4溶液完全褪色所需的时间不能KMnO4能氧化盐酸
【解析】(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则实际H2C2O4溶液的量增大,导致消耗标准液的体积增大,测得H2C2O4溶液的浓度会偏大;
(3)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为浅紫色,红色30s内不褪去,说明滴定到终点;
(4)由关系式 2KMnO4~5H2C2O4可知,n(H2C2O4)=![]() V(KMnO4)c(KMnO4)=
V(KMnO4)c(KMnO4)=![]() ×0.1000molL-1×0.0200L=0.005mol,则25mL草酸溶液中草酸物质的量浓度为
×0.1000molL-1×0.0200L=0.005mol,则25mL草酸溶液中草酸物质的量浓度为![]() =0.2mol/L;
=0.2mol/L;
(5)①、②和③探究的是草酸的浓度对速率的影响,且要保持硫酸和KMnO4溶液浓度不变,要求混合液的总体积相等,表中V1=(2.0+5.0+6.0+7.0)-(2.0+8.0+6.0)=4.0,V2=(2.0+5.0+6.0+7.0)-(2.0+2.0+6.0)=10.0。
(6)实验中需要测量的数据是KMnO4溶液完全褪色所需的时间;
(7)因酸性条件下KMnO4溶液能氧化HCl,故不能用盐酸代替稀硫酸。
点睛;在酸碱中和滴定实验中,滴定管都要事先检查是否漏液,用水洗后再用待装溶液润洗。在酸碱中和滴定实验中,误差分析时,考虑所有的操作对标准溶液体积的影响,例如用来装待测液的滴定管没有润洗,则待测液的浓度变小,需要的标准液体积变小,则结果变小。若用待测液润洗锥形瓶,则待测液的体积变大,需要的标准液变多,结果偏大。标准液的滴定管没有润洗,标准液浓度变小,需要的体积变大,结果变大。对于滴定过程中的读数情况,看标准液的体积变化,体积变大,结果变大,体积变小,体积变小。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】2,3-二氢呋喃(![]() )可用于电子化学品和香料中,其合成路线如下:
)可用于电子化学品和香料中,其合成路线如下:
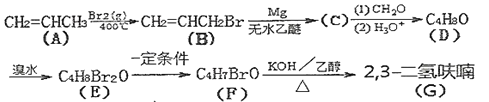
已知:
回答下列问题:
(1)A→B的反应类型为___________。
(2)A的名称为___________;B所含官能团的名称为___________。
(3)写出E的结构简式______________________。
(4)写出F→G的化学方程式______________________。
(5)满足下列条件的F的同分异构体共有___________种。
①含![]() ; ②不含环状结构 ; ③不考虑立体异构。
; ②不含环状结构 ; ③不考虑立体异构。
(6)写出符合下列条件的D的同分异物体的结构简式___________。
①能发生银镜反应。②核磁共振氢谱有三种峰且峰面积之比为6︰1︰1。
(7)写出用1,3-丁二烯为原料制备四氢呋喃(![]() )的合成路线_____________________(无机试剂任选)。
)的合成路线_____________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中①~⑦表示元素周期表的部分元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
1 | |||||||
2 | ① | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ |
(1)②元素最外层电子数比次外层电子数多______个,该元素的符号是_______;⑦元素的氢化物的电子式为____________________。
(2)由①③④三种元素组成的物质是______________,此物质的水溶液显_____性。
(3)⑥元素的原子半径大于③的理由是____________________________________。
(4)④元素的最高价氧化物对应的水化物的碱性强于⑤元素,用一个化学方程式来证明。________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是

A. 由甲可知:使用催化剂不影响反应热
B. 由乙可知:对于恒温恒容条件下的反应2NO2 (g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C. 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D. 由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.204×1023个氧气分子的体积是________L;
(2)标准状况下,某气体的密度为1.25 g·L-1,则其摩尔质量为________;
(3)将4.6 g钠投入足量的水中,生成NaOH的质量为______g,生成H2的体积在标准状况下为____________。
(4)400 mL某浓度的NaOH溶液恰好与11.2 L Cl2(标准状况)完全反应,生成NaClO的物质的量为________,原NaOH溶液物质的量浓度为_________________。
(5)在标准状况下,CO和CO2的混合气体共17.92 L,质量为28.8 g。则两种气体的物质的量之和为____________mol,其中CO2为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离:其中试剂1、2、4分别为( )

A.氯化钡溶液、硝酸银溶液、稀硝酸
B.氯化钡溶液、稀硝酸、硝酸银溶液
C.氢氧化钠溶液、硝酸银溶液、稀硝酸
D.硝酸银溶液、硝酸钡溶液、稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设用NA表示阿伏加德罗常数的值,其计算近似值为6.02×1023,按要求完成下列填空:
①0.5mol NH3共含有____个原子。
②6mol H2O与标准状况下___LNH3所含氢原子数相等。
③某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是____。
④标准状况下11.2L NO和____g NO2所含有的氧原子数相等。
⑤0.8g某物质含有3.01×1022个分子,该物质的相对分子质量约为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com