
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |

分析 (1)根据仪器的结构确定仪器的名称;正丁醇易挥发,通过球形冷凝管冷凝、回流,提高原料的利用率;液体加热时,需要加碎瓷片,防止暴沸;
(2)在此反应过程中生成了溴化氢气体,会对环境产生污染,故需用碱液进行吸收;
(3)正溴丁烷中含有正丁醇杂质,这两种液体是相互溶解的有机物,只能采用蒸馏的方法进行分离;
(4)如果采用大火加热回流时,在较高的温度下会发生很多其他的副反应,如浓硫酸在温度较高的情况下氧化性更强,可能会把乙醇等有机物氧化,正丁醇和正丁烷的沸点都比较低,易逸出等都会使产率降低.
(5)先根据方程式C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O计算出C4H9Br的理论值,然后用实际值除以理论值即产率;
解答 解:(1)仪器A的名称是圆底烧瓶;正丁醇易挥发,通过球形冷凝管冷凝、回流,提高原料的利用率;
操作中加入沸石的作用是防止暴沸;
故答案为:圆底烧瓶;冷却、回流;防止暴沸;
(2)反应过程中生成了溴化氢气体,会对环境产生污染,可通过NaOH溶液进行吸收;
故答案为:NaOH溶液;吸收逸出的溴化氢,防止其污染空气;
(3)正溴丁烷中含有正丁醇杂质,这两种液体相互溶解,只能采用蒸馏的方法进行分离;
故选d;
(4)如果采用大火加热回流时,在较高的温度下会发生很多其他的副反应,如浓硫酸在温度较高的情况下氧化性更强,可能会把乙醇等有机物氧化,正丁醇和正丁烷的沸点都比较低,易逸出等都会使产率降低.
故答案为:低;大火,副反应多或产物逸出较多;
(5)m(C4H9OH )=18.5mL×0.80g•cm-3=14.8g,则n(C4H9OH )=$\frac{14.8g}{74g/mol}$=0.2mol
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
1mol 1mol
2mol 0.2mol
所以m(C4H9 Br)=0.2mol×137g/mol=27.4g,产率为$\frac{13.6g}{27.4g}$×100%=49.6%;
故答案为:49.6%;
点评 本题以正丁醇制备正溴丁烷为背景,考查物质的分离提纯、性质实验方案设计,仪器的作用,化学计算,题目阅读量较大,对学生的心理素质有一定的要求,是对学生综合能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成474 g Na2S2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
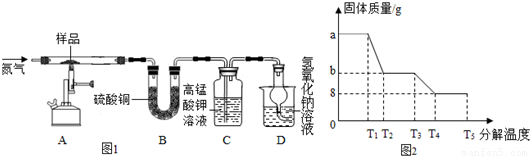
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
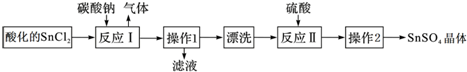
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
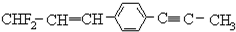 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 12个碳原子不可能都在同一平面上 | |
| B. | 处于同一直线上的原子最多有4个 | |
| C. | 处在同一平面上的原子最多有20个 | |
| D. | 除苯环外的其余碳原子有可能都在同一直线上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com