
 .
.分析 (1)过氧化钠是离子化合物,由钠离子与过氧根离子构成;
(2)氯气和二氧化硫按照1:1的体积同时通入品红溶液中,反应生成硫酸和盐酸,不具有漂白性;
(3)高锰酸钾具有氧化性,HCl本身具有还原性,在酸性条件下,MnO4-被还原成Mn2+;
(4)根据化合价升降总数相等以及原子、电荷守恒来解答.
解答 解:(1)过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为 ,
,
故答案为: ;
;
(5)Cl2和二氧化硫以1:1通入品红溶液中,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,漂白效果将失去,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(3)HCl本身具有还原性,能被高锰酸钾氧化成氯气,在酸性条件下,MnO4-被还原成Mn2+,依据氧化还原反应电子守恒、电荷守恒、原子守恒配平写出,
离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)Cr2O72-具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,Cr2O72-被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个Cr2O72-化合价变化6,两者的最小公倍数是12,根据得失电子和电荷守恒配平得2Cr2O72-+3C2H5OH+16H+═4Cr3++3CH3COOH+11H2O,
故答案为:2Cr2O72-+3C2H5OH+16H+═4Cr3++3CH3COOH+11H2O.
点评 本题考查常用化学用语,掌握电子式的书写、氧化还原反应配平是解答关键,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
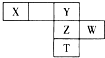 如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )
如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )| A. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| B. | T的最高价氧化物对应的水化物酸性比Z的强 | |
| C. | Y的氢化物沸点高于Z的氢化物,因为H-Y键的键能高于H-Z键 | |
| D. | XY2、XZ2、XW4的化学键类型相同、晶体类型也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个 | |
| C. | 金属晶体中,铜和锌都是面心立方堆积 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 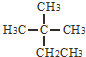 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(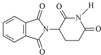 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com