
性质决定用途,化学知识运用得当可以使人类的生活更美好.下列物质性质与应用的对应关系正确的是( )
|
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 |
|
| B. | 浓硫酸具有酸性,可用于刻蚀玻璃制品 |
|
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 |
|
| D. | 氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| 硅和二氧化硅;浓硫酸的性质;两性氧化物和两性氢氧化物.. | |
| 分析: | A.硅位于非金属和金属分界线处,能制作半导体材料; B.用于刻蚀玻璃制品的是HF; C.漂白粉具有漂白性,能漂白纸张; D.氢氧化铝具有弱碱性,能中和酸. |
| 解答: | 解:A.晶体硅熔点高硬度大可以制作玻璃刀等,硅位于金属和非金属分界线处,可用于制作半导体材料,二者没有关系,故A错误; B.用于刻蚀玻璃制品的是HF,HF是弱酸属于特殊的性质,与浓硫酸具有酸性无关,故B错误; C.漂白粉具有漂白性,能漂白纸张,与漂白粉的稳定性强弱无关,所以二者没有对应关系,故C错误; D.胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,二者有对应关系,故D正确; 故选D. |
| 点评: | 本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大. |


科目:高中化学 来源: 题型:
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如下图所示,回答下列问题:
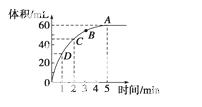
(1)A、B、C、D四点化学反应速率快慢的顺序为
________________________________________________________________________。
(2)解释反应速率变化的原因
________________________________________________________________________。
(3)计算过氧化氢的初始 物质的量浓度
物质的量浓度
________________________________________________________________________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法.下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀硫酸加入Ba(OH)2溶液至中性 2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O | NaHSO4溶液加入Ba(OH)2溶液至中性 H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH﹣═AlO2﹣+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═AlO2﹣+2H2O+4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH﹣═HCO3﹣ | 向Ca(OH)2溶液中通入过量SO2 SO2+OH﹣═HSO3﹣ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠和钠的化合物的叙述不正确的是( )
A. 热稳定性:Na2CO3>NaHCO3
B.Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
C.碳酸氢钠可用于治疗胃酸过多
D.Na2O2中阴、阳离子的个数比为1∶ 2
查看答案和解析>>
科目:高中化学 来源: 题型:
“温室效应”是哥奉哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是 (填字母编号)。
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导“低碳”生活
c.利崩太阳能、风能等新型能源替代化石燃料 ·
(2)CH4是另一种主要的温室气体,l克甲烷完全燃烧生成液态水和二氧化碳,放出55.64 kJ的热量,写出甲烷的燃烧热的热化学方程式 。
(3)酸阿的形成主要是由废气中的SOx和NOx造成的。通过SO2和Br2、H2O的定量反应在电解池中产生的电流变化,可以准确测定空气中SO2的含量。该反应的化学方程式为 。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。 第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2 2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g) 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
a. SO2为5mol·L-1,O2为3.5mol·L-1 b. SO2为3mol·L-1
c. SO2、SO3均为2.5mol·L-1 d. SO3为5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨做电极电解1mol/L CuSO4溶液,当c(Cu2+)为0.5mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况( )
|
| A. | CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
( )
|
| A. | ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓ |
|
| B. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
|
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
|
| D. | d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2SO4的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为
A.2:3 B.3:8 C.1:4 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) 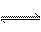 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com