
出下列反应化学方程式,并写出该反应属于何反应类型.
(1)乙烯使溴水退色 ;
(2)苯与浓硫酸和浓硝酸的混合液共热 ;
(3)由乙炔制聚氯乙烯 ;
(4)乙烷与Cl2在光照条件下1:1反应:
(5)3﹣甲基﹣1﹣丁炔与溴的四氯化碳溶液按物质的量为1:1反应:
(6)用甲苯制2,4,6﹣三溴甲苯:
考点: 有机化学反应的综合应用.
专题: 有机反应.
分析: (1)乙烯含有碳碳不饱和键,能和溴发生加成反应;
(2)苯在浓硫酸作用下与浓硝酸加热反应生成硝基苯,该反应为取代反应;
(3)乙炔可以和氯化氢加成生成氯乙烯,氯乙烯加聚可以制的聚氯乙烯;
(4)根据烷烃与卤素单质在光照条件下发生取代反应得到卤代烃来写;
(5)3﹣甲基﹣1﹣丁炔与溴的四氯化碳溶液按物质的量为1:1发生加成反应来写;
(6)甲苯邻对位氢原子可被溴取代生成2,4,6﹣三溴甲苯.
解答: 解:(1)含有不饱和键的有机分子能发生加成反应,有机物分子中的不饱和键断裂,断键原子与其它原子或原子团相结合,生成新的化合物.乙烯含有碳碳双键,能和溴反应生成1,2﹣二溴乙烷,化学方程式为Br2+CH2=CH2→BrCH2CH2Br,
故答案为:Br2+CH2=CH2→BrCH2﹣CH2Br;加成反应;
(2)将苯滴入浓硝 酸和浓硫酸混合液中,并在50℃﹣60℃反应生成硝基苯和水,其反应的化学方程式为:
酸和浓硫酸混合液中,并在50℃﹣60℃反应生成硝基苯和水,其反应的化学方程式为: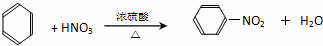 ,该反应为取代反应,
,该反应为取代反应,
故答案为: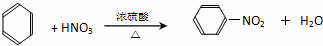 ;取代反应;
;取代反应;
(3)乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应,发生的反应为CH≡CH+HCl CH2=CHCl
CH2=CHCl ,
,
CH2=CHCl发生加聚反应为nH2C=CHCl
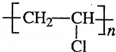 ,
,
故答案为:CH≡CH+HCl CH2=CHCl,加成反应;nH2C=CHCl
CH2=CHCl,加成反应;nH2C=CHCl
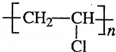 ,加聚反应;
,加聚反应;
(4)因烷烃与卤素单质在光照条件下发生取代反应得到卤代烃,所以乙烷与Cl2在光照条件下1:1反应的化学方程式是:CH3﹣CH3+Cl2 CH3﹣CH2Cl+HCl,
CH3﹣CH2Cl+HCl,
故答案为:CH3﹣CH3+Cl2 CH3﹣CH2Cl+HCl;取代反应;
CH3﹣CH2Cl+HCl;取代反应;
(5)3﹣甲基﹣1﹣丁炔与溴的四氯化碳溶液按物质的量为1:1反应发生加成反应,反应方程式为:CH≡C﹣CH(CH3)﹣CH3+Br2→CHBr=CBr﹣CH(CH3)﹣CH3,
故答案为:CH≡C﹣CH(CH3)﹣CH3+Br2→CHBr=CBr﹣CH(CH3)﹣CH3;加成反应;
(6)甲苯邻对位氢原子可被溴取代生成2,4,6﹣三溴甲苯,反应方程式为: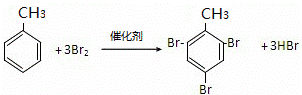 ;
;
故答案为: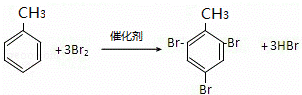 ;取代反应.
;取代反应.
点评: 本题考查有机化学反应方程式书写,为高频考点,把握有机物的结构与性质、官能团与性质的关系为解答的关键,注意有机反应类型及反应条件,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在一种酸性溶液中,可能存在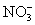 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活和社会密切相关.下列说法不正确的是()
A. 漂白粉长期暴露在空气中会变质失效
B. 雾霾天车灯照射的光亮通路属于丁达尔现象
C. 硬铝属于合金材料,瓷器属于硅酸盐制品
D. 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N5+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
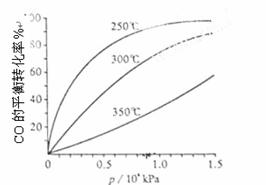
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”) 。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F
B.Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4
D.CaHPO4和Ca(H2PO4)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com