
【题目】有相同质子数的微粒一定是( )
A.同种元素
B.同种分子
C.同种原子
D.不能确定
科目:高中化学 来源: 题型:
【题目】下列关于常温下的溶液叙述正确的是
A.Mg(OH)2可溶于一定浓度的NH4Cl溶液
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为u和u+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色
D.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO![]() )>c(NH
)>c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液
B. 可用勒夏特列原理解释2NO2(g)![]() N2O4(g)体系加压后颜色变深
N2O4(g)体系加压后颜色变深
C. N2(g)+ 3H2(g)![]() 2NH3(g) ΔH<0可通过加压方式增大其平衡常数
2NH3(g) ΔH<0可通过加压方式增大其平衡常数
D. 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体
查看答案和解析>>
科目:高中化学 来源: 题型:
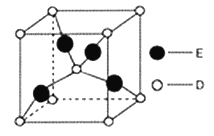
【题目】已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )。
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各有机物同分异构体数目(不考虑立体异构)的判断中正确的是
A. 分子式为C4H8,能发生加成反应的同分异构体有2种
B. 分子式为C8H10的二甲苯,苯环上.的一个氢原子被溴原子取代,所得产物有6种
C. 分子式为C4H8Cl2,只有一个甲基的同分异构体有5种
D. 分子式为C5H10O2,只有一个官能团,且能溶于水的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)元素周期表1~20号元素中,金属性最强的元素是__________(填元素符号,下同);属于稀有气体的是________________;非金属性最强的元素在周期表中的位置是_______________________。
(2)已知NO2和N2O4之间发生可逆反应:2NO2 (g) (红棕色) ![]() N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
N2O4(g) (无色)。将装有NO2 和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________。
(3)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
2NH3(g),3min时反应达到平衡状态,测得c(N2)=0.02mol·L-1。
① 0~3min内,v (NH3)=___________________。
②下列叙述可证明上述反应达到平衡状态的是_________(填序号)。
a. v(H2)= 3 v(N2) b.容器内压强保持不变
c.每消耗1mol N2,同时生成2mol NH3
d. N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
A. CH3CH2CH2CH3 B. CH3CH(CH3)2
C. CH3C(CH3)3 D. (CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
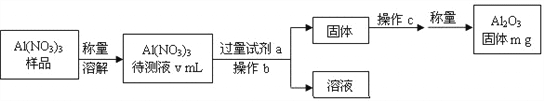
①加入过量试剂a,发生反应的离子方程式为___________________________。
②生成氧化铝的化学反应方程式是_______________________________________。
③Al(NO3)3待测液中,c (Al3+) = ______mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
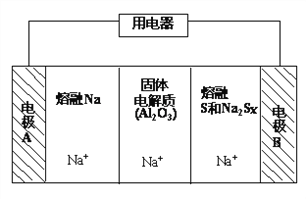
①据下表数据,请你判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
a .100℃以下 b . 300℃~ 350℃ c. 100℃~ 300℃ d. 350℃~ 2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
②该电池工作时,2Na + xS(3<x<5)=Na2Sx,则电极A上发生的电极反应式是_______。
内电路中Na+的移动方向为_________(填“从A到B”或“从B到A”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com