
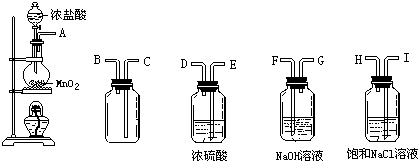
分析 (1)根据实验的目的和反应的原理可知,实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气,据此排序;
(2)制备气体,按装完仪器后首先应检查装置的气密性;
(3)①氯化氢易挥发,制备的氯气中含有氯化氢杂质,通过饱和食盐水可以吸收氯化氢;
②浓硫酸具有吸水性,能干燥氯气;
③氯气有毒,直接排放能引起环境污染,氯气与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气,进行尾气处理.
解答 解:(1)实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,所以仪器连接顺序为:A、I、H、E、D、C、B、F;
故答案为:A、I、H、E、D、C、B、F;
(2)制备气体,按装完仪器后首先应检查装置的气密性;
故答案为:检查装置气密性;
(3)①盐酸易挥发,所以制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用饱和食盐水除去氯化氢气体;
故答案为:除去氯化氢气体;
②浓硫酸具有吸水性,能干燥氯气;
故答案为:除去水蒸气;
③氯气有毒,不能直接排放到空气中,氯气与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气,防止空气污染,
故答案为:吸收剩余氯气,防止污染空气.
点评 本题考查了制取氯气实验相关内容的探究,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 雨水样品酸性逐渐减小 | |
| B. | 雨水样品酸性没有变化 | |
| C. | 雨水样品pH降低的原因可能是继续吸收空气中的CO2 | |
| D. | 雨水样品中的pH降低的原因可能是H2SO3逐渐被氧气氧化成H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的电离:NaHCO3?Na++H++CO32- | |
| B. | HS-的水解:HS-+H2O?H3O++S2- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(T℃)下的溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:| 实验 序号 | Ba(OH)2溶液 的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 9 |
| ② | 22.00 | 18.00 | b |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3和Al3+ | B. | Al(OH)3 | ||
| C. | Al3+、Al(OH)3 和AlO2- | D. | 全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com