
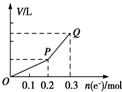
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.1mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.1mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
分析 电解CuSO4溶液时,开始发生反应:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,一段时间后,转移相同电子时得到气体体积增大,说明发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,第一过程相当于析出CuO,第二过程电解水,要使电解后的溶液恢复原状应加入CuO及水,由图可知析出Cu为$\frac{0.2mol}{2}$=0.1mol,则需要加入1molCuO,第二阶段消耗的水为$\frac{0.1mol}{2}$=0.05mol,结合选项判断.
解答 解:电解CuSO4溶液时,开始发生反应:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,一段时间后,转移相同电子时得到气体体积增大,说明发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑.
由图可知,第一阶段析出Cu为$\frac{0.2mol}{2}$=0.1mol,则需要加入1molCuO,第二阶段消耗的水为$\frac{0.1mol}{2}$=0.05mol,
由于CuCO3反应生成二氧化碳,相当于加入CuO,Cu(OH)2可以改写为CuO.H2O,Cu2(OH)2CO3可以改写为2CuO.H2O.CO2,故加入0.05 mol Cu2(OH)2CO3,等效为加入1molCuO、0.05molH2O,溶液可恢复为电解前的浓度,
故选:D.
点评 本题考查电解原理及有关计算,明确离子放电顺序及电解过程中发生的反应是解本题关键,注意转移电子守恒的灵活运用,侧重考查学生分析计算能力,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
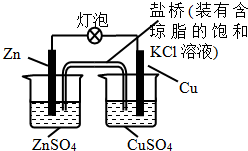
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-=Zn2+ | |
| C. | 在外电路中,电流从锌棒流向铜棒 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: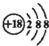 | |
| B. | NaClO的电子式: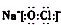 | |
| C. | 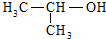 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{78}$ I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 平衡时气体平均相对分子质量约为23.3 | |
| D. | 其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
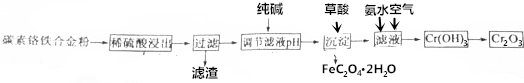
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
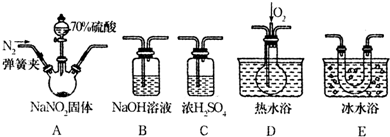
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com