
【题目】某同学用如图所示装置制备并检验Cl2的性质.下列说法正确的是( ) 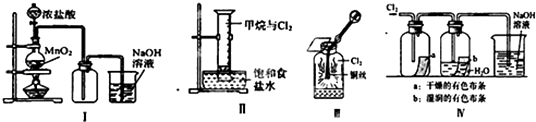
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
【答案】D
【解析】解:A.浓盐酸和二氧化锰反应生成氯气,而稀盐酸和二氧化锰不反应,所以无论二氧化锰是否过量,盐酸都无法完全反应,故A错误;
B.光照条件下,甲烷和氯气发生取代反应而不是加成反应,故B错误;
C.铜在氯气中燃烧产生棕色烟,向集气瓶中加入水,溶液呈蓝色,故C错误;
D.氯气和水反应生成盐酸和次氯酸,起漂白作用的是次氯酸,氯气与水反应生成的氯化钠和次氯酸钠在酸性溶液中会发生归中反应而生成氯气,故D正确;
故选D.
A.二氧化锰和稀盐酸不反应;
B.光照条件下,甲烷和氯气发生取代反应;
C.铜在氯气中燃烧产生棕色烟;
D.起漂白作用的是次氯酸,氯气与水反应生成的氯化钠和次氯酸钠在酸性溶液中会发生归中反应.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】100 g碳燃烧所得气体中,CO占1/3 体积,CO2占 2/3 体积,且C(s)+ 1/2 O2(g)====CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+ ![]() O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)====CO2(g) ΔH=-282.57 kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92 kJ B.2 489.44 kJ C.784.92 kJ D.3 274.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,碳氢两种元素的质量比是一个定值的是( )
A.CH4、C2H4
B.C2H4、C4H8
C.C2H6、C2H2
D.C2H4、C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA。下列说法正确的是
A. 常温下,14 g的![]() C含中子数目为6NA
C含中子数目为6NA
B. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
C. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:

下列说法正确的是
A. 蒿甲醚的化学式为C16H25O5
B. ①、②反应依次为加成反应、取代反应
C. 青蒿素因含酯基具有氧化性和杀菌功能
D. 上述三种有机物的含氧官能团完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO3 ![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态.
A.①④
B.②③
C.①③④
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com