
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变红色,说明SO2呈酸性 | |
| B. | 品红溶液褪色,说明SO2具有漂白性 | |
| C. | 溴水橙色褪去,体现了SO2的还原性 | |
| D. | 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应 |
分析 A.SO2不能漂白酸碱指示剂;
B.SO2具有漂白性,能使品红溶液褪色;
C.SO2具有还原性,Br2具有强氧化性,二者发生氧化还原反应生成HBr和硫酸;
D.SO2属于酸性氧化物,SO2和NaOH溶液反应生成亚硫酸钠而降低溶液碱性.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸电离出氢离子而使其溶液呈酸性,紫色石蕊试液遇酸变红色,所以溶液呈红色,二氧化硫不显酸性,故A错误;
B.SO2和有色物质反应生成无色物质而具有漂白性,所以品红溶液褪色体现二氧化硫的漂白性,故B正确;
C.SO2具有还原性,Br2具有强氧化性,二者发生氧化还原反应生成HBr和硫酸,反应方程式为Br2+SO2+2H20=2HBr+H2SO4,该反应体现二氧化硫的还原性,故C正确;
D.SO2属于酸性氧化物,SO2和NaOH溶液反应生成亚硫酸钠而降低溶液碱性,所以将二氧化硫通入含有酚酞的NaOH溶液中,NaOH溶液会褪色,该现象说明二氧化硫属于酸性氧化物能够和NaOH反应,故D正确;
故选A.
点评 本题考查二氧化硫的性质,知道二氧化硫、次氯酸漂白原理的区别,注意二氧化硫不能漂白酸碱指示剂,为易错点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
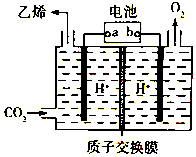 CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )
CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题.如图所示电解装置可将CO2转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极.下列有关说法正确的是( )| A. | a为电池的正极 | |
| B. | 电解过程中H+移向阳极 | |
| C. | 反应前后溶液的pH保持不变 | |
| D. | 阴极反应式:2CO2+12H++12e-=C2H4+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释、结论 |
| A | 把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯
可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯 .
.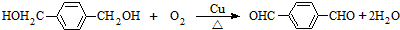 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: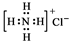 | B. | Cl-的结构示意图: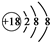 | ||
| C. | 葡萄糖的实验式:CH2O | D. | 对硝基苯酚的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
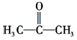
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com