
【题目】某结晶水合物A含有两种阳离子和一种阴离子.将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24L(标准状况)刺激性气味的气体.向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60g. 请回答以下问题:
(1)A的摩尔质量为 .
(2)试通过计算确定该结晶水合物的化学式为 .
(3)若第二份加入75.00mL2.00molL﹣1的Ba(OH)2溶液,则得到的沉淀质量为 .
【答案】
(1)453g/mol
(2)NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O]
(3)42.75g
【解析】解:(1)一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,证明一定含有NH4+;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有Al3+ , 由题中信息可知45.3g的该结晶水合物中:n(SO42﹣)= ![]() ,n(NH4+)=n(NH3)=
,n(NH4+)=n(NH3)= ![]() ,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42﹣)可得:n(Al3+)=
,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42﹣)可得:n(Al3+)= ![]() (2×0.2mol﹣0.1 mol)=0.1 mol,根据质量守恒可知45.3g该结晶水化合物中含有水的物质的量为:n(H2O)=
(2×0.2mol﹣0.1 mol)=0.1 mol,根据质量守恒可知45.3g该结晶水化合物中含有水的物质的量为:n(H2O)= ![]() =1.2mol,所以该结晶水合物中:m(NH4+):n(Al3+):n(SO42﹣):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
=1.2mol,所以该结晶水合物中:m(NH4+):n(Al3+):n(SO42﹣):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,
故该结晶水合物的化学式为:NH4Al(SO4)212H2O[或(NH4)2SO4Al2(SO4)324H2O],其摩尔质量为453g/mol,
所以答案是:453g/mol;(2)根据(1)可知该结晶水合物的化学式为NH4Al(SO4)212H2O[或(NH4)2SO4Al2(SO4)324H2O],
所以答案是:NH4Al(SO4)212H2O[或(NH4)2SO4Al2(SO4)324H2O];(3)45.3g晶体的物质的量= ![]() ,n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,n(NH4Al(SO4)2):n(Ba(OH)2)=0.1mol:0.15mol=
,n(Ba(OH)2)=2.0mol/L×0.075L=0.15mol,n(NH4Al(SO4)2):n(Ba(OH)2)=0.1mol:0.15mol= ![]() >
> ![]() ,所以氢氧化钡不足量,根据原子守恒知,生成n(BaSO4)=n(Ba(OH)2)=0.15mol,生成n(Al(OH)3)=
,所以氢氧化钡不足量,根据原子守恒知,生成n(BaSO4)=n(Ba(OH)2)=0.15mol,生成n(Al(OH)3)= ![]() n(Ba(OH)2)=0.1mol,所以沉淀的质量=0.15mol×233g/mol+0.1mol×78g/mol=34.95g+7.8g=42.75g,
n(Ba(OH)2)=0.1mol,所以沉淀的质量=0.15mol×233g/mol+0.1mol×78g/mol=34.95g+7.8g=42.75g,
所以答案是:42.75g.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.实验室用加热NH4Cl固体的方法制备NH3
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.工业上用SO2漂白纸浆、毛、丝、草帽辫等
D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物.某学习小组欲探究其分解产物.
(1)甲组同学设计了如图1所示实验装置. 
(i)实验中,装置B中观察到的现象是 .
(ii)碱石灰的主要作用是 .
(iii)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有(写化学式).
(iv)设计实验验证装置A中固体残留物不含FeO:(简要说明实验操作、现象和结论).
(2)乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2 . 为进行验证,用甲组实验中的装置A和下列如图2所示装置进行实验.
说明此固体产物不含FeO|多余
(i)乙组同学的实验装置中,依次连接的合理顺序为A、 . 装置G中盐酸的作用是
(ii)实验中,准确称量摩尔盐7.8400g,充分加热反应后,测得装置A中固体残留物的质量为1.6000g,装置G中生成白色沉淀的质量为3.4950g,装置H中收集到112mL N2(标准状况下),写出摩尔盐受热分解的化学方程式: . (分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2OH(CHOH)4CHO是葡萄糖的结构简式,它不可能发生的化学反应是( )
A.燃烧
B.银镜反应
C.水解反应
D.与新制备的Cu(OH)2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁和氧化铁的混合物5.44g加入50mL 3.2molL﹣1的盐酸,恰好完全反应,滴入KSCN溶液后不显红色.若忽略溶液体积的变化,则在所得溶液中Fe2+的浓度约为( )
A.0.2molL﹣1
B.0.4molL﹣1
C.0.8molL﹣1
D.1.6molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
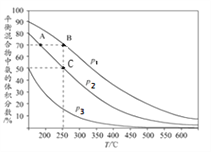
①由图可知:p1、p2、p3的大小关系为________,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________,C点,N2的转化率为_____。
③下列关于合成氨的说法正确是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为:AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是

A. 生成108 g银,转移电子个数为1 mol
B. Cu+在负极发生氧化反应
C. Ag电极活泼,Ag失电子发生氧化反应
D. Cl-由负极迁移到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________。
(3)爆炸残留在废水中的CN-可以用Cr2O![]() 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,

①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________;
③步骤③中,每处理0.4 mol Cr2O![]() 时转移电子2.4 mol,该反应的离子方程式_________;
时转移电子2.4 mol,该反应的离子方程式_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com