(2011?杭州一模)某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)
2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是:
NH4+
NH4+
和
Al3+
Al3+
.
(2)试通过计算确定该结晶水合物的化学式为
NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O]
NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O]
.
(3)假设过程中向该溶液中加入的Ba(OH)
2溶液的物质的量浓度为2.0mol?L
-1.
①加入Ba(OH)
2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O
NH4++Al3++4OH-+2Ba2++2SO42-=2BaSO4↓+Al(OH)3↓+NH3.H2O
.
②若加入75mL的Ba(OH)
2溶液,则得到的沉淀质量为
42.75
42.75
g.



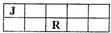 (2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )