
����Ŀ������ǽ��ڷ��»����ͻ�ѧ��֮���һ�����������㷺���������������У������ͨʽ�ɱ�ʾΪX��H��Y������X��Y���Ƿǽ����Խ�ǿ���뾶��С��ԭ�ӣ���F��O��N�ȣ�X��Y������ͬ��ԭ��Ҳ�����Dz�ͬ��ԭ�ӣ�
��1���������ͨʽ�ֱ��ʾ������H2O���Ӽ����� �� ��ˮ��H2O������NH3����֮������ ��
��2����֪ˮ��2��ˮ����֮����Է���������ż���룬���뷽��ʽΪ��2H2OH3O++OH�� �� ʵ������Һ����2��NH3����֮��Ҳ�������ص������ɺ�����ͬ�����������ӣ�����뷽��ʽ�ǣ� �� д�����������ӵĵ���ʽ�� ��
���𰸡�
��1��O��H��O��O��H��N��N��H��O
��2��NH3+NH3?NH4++NH2����![]() ��
��![]()
���������⣺��1������һ��ˮ���ӵ�Oԭ������һ��ˮ�����е�Hԭ���γ����������ʾΪO��H��O����ˮ��H2O��Oԭ����NH3�����е�Hԭ���γ��������N��H��O��H2O��Hԭ����NH3�����е�Nԭ��Ҳ�γ��������O��H��N�����Դ��ǣ�O��H��N��O��H��N��N��H��O����2��ˮ��������H3O+��OH������ˮ����ż���룮ͬˮһ����Һ��Ҳ����ż���룬����ż����ķ���ʽΪ��NH3+NH3NH4++NH2����NH4+�Ƕ�ԭ�ӹ��ɵ������ӣ�����ʽҪ�������ź͵�ɣ������ʽΪ�� ![]() ��NH2��Ϊ��ԭ�ӹ��ɵ������ӣ�����ʽҪ�������ź͵�ɣ������ʽΪ��
��NH2��Ϊ��ԭ�ӹ��ɵ������ӣ�����ʽҪ�������ź͵�ɣ������ʽΪ�� ![]() �����Դ��ǣ�NH3+NH3NH4++NH2����
�����Դ��ǣ�NH3+NH3NH4++NH2���� ![]() ��
�� ![]() ��
��
�����㾫�����������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO��g��+O2��g���T2CO2��g����H=��566kJmol��1
N2��g��+O2��g���T2NO��g����H=+180kJmol��1
��2CO��g��+2NO��g���TN2��g��+2CO2��g���ġ�H�ǣ� ��
A.��386 kJmol��1
B.+386 kJmol��1
C.��746 kJmol��1
D.+746 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ��磬�������ڵ���ʵĻ�������
A��SO3 B��Cl2
C��NH4NO3 D��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���л������Ľṹ��ʽΪ �����й������������в���ȷ����(���� )
�����й������������в���ȷ����(���� )
A. ![]() ��һ�������·������۷�Ӧ���ɺϳɸ��л�����
��һ�������·������۷�Ӧ���ɺϳɸ��л�����
B. ���л������ܷ���������Ӧ
C. �ϳɸ��л�������ԭ�Ͽ����м���
D. ����һ�������·���ˮ�ⷴӦʱC��O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����й㷺��Ӧ�ã��ɷ�Ǧ��(PbS)�Ʊ�Ǧ���ص缫����(PbO2)�ķ������£�
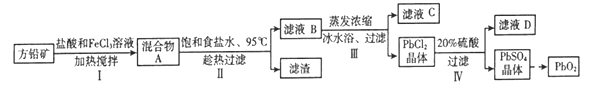
�������ϣ���PbCl2(s)+2Cl-(aq) ![]() PbCl42-(aq) ��H��0
PbCl42-(aq) ��H��0
��Fe3+��Pb2+������������ʽ��ʼ����ʱ��PHֵ�ֱ�Ϊ1.9��7.0
�۲�ͬ�¶Ⱥ�Ũ�ȵ�ʳ����Һ��PbCl2���ܽ��(g L-1):
| 20 | 40 | 60 | 100 | 180 | 260 | 300 |
13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
(1)����I��FeCl3��Һ��PbS��Ӧ����PbCl2��S�Ļ�ѧ����ʽΪ__________________��
�����������pHС��1.0��ԭ����________��
(2)����II�н����ܽ�ʱ����95��ͱ���ʳ��ˮ��Ŀ�ķֱ���____________��_____________��
(3)����III�н���ҺB����Ũ�������ñ�ˮԡ��ԭ����___________(����ƽ���ƶ�ԭ������)��
(4)��IV����������������Ϊ20%���ܶ�Ϊ1.22 g��cm-3��������Һ������������������Ϊ98.3%���ܶ�Ϊ1.84 g��cm-3��Ũ�������ƣ����õ��IJ���������___________ (����Ӧ����ĸ)��
A.�ձ� B.��Ͳ C.����ƿ D.��ƿ E.������ F.��ͷ�ι�
(5)��Ǧ����Ϊ��Դ�����õ�ⷨ�ֿ���������Cr2O72-������NO2-�����Է�ˮ(����Cr2O72-ת��ΪCr(OH)3, NO2-ת��Ϊ�����ʣ�����װ������ͼ��ʾ��
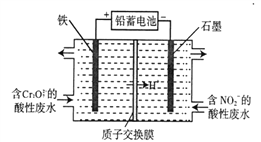
�������Cr2O72-ת��ΪCr3+�����ӷ���ʽ��__________________��
�ڵ�����������2 mol NO2-ʱ���ҳؼ��ٵ�H+�����ʵ���Ϊ______________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | ���������Ӳ㣬K��M�������֮�͵���L������� |
B | �������н�������ǿ |
C | �����µ���Ϊ˫ԭ�ӷ��ӣ��⻯���ˮ��Һ�ʼ��� |
D | Ԫ�����������+7�� |
��1���û�ѧ����ش��������⣺
��AԪ�������ڱ��е�λ����
��C���ʷ��ӵĵ���ʽ��
��D��ԭ�ӽṹʾ��ͼ��
�ܵ���ʽ��ʾA��BԪ����ɵĻ�������γɹ��̣� ��
��2��Ԫ��D��Ԫ��A��ȣ��ǽ����Խ�ǿ��������Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ��������ѡ����ţ���
a��������D�ĵ��ʺ�A�ĵ���״̬��ͬ
b��D���⻯���A���⻯���ȶ�
c��һ��������D��A�ĵ��ʶ������Ʒ�Ӧ
d��A��ۺ��������������D��ۺ�����
e��D��������A���⻯�ﷴӦ����A����
��3��X����A��B��C��D����Ԫ���е�ij��Ԫ����ɵĵ��ʣ��ܾ�ͼ��ʾ�Ĺ���ת��Ϊ������������ȥ���� ![]()
����Y���д̼�����ζ����ɫ���壬��Yͨ��BaCl2��Һ�У�������Ȼ��μ�����H2O2��Һ���а�ɫ�������ɣ���ð�ɫ����Ϊ �� ��д��Y��H2O2��Һ��Ӧ�Ļ�ѧ����ʽ����
����Z�Ǻ���ɫ���壬��Z��W�ķ�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɣ�
��ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������ͬ����Ԫ��C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼ2װ������֤±��Ԫ�ص����ʵݱ���ɣ�
ͼ2��A��B��C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ��ĺ�ֽ������֪������Ũ�������������ܷ�Ӧ������������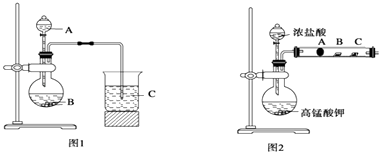
��1����ͬѧ��Ƶ�ʵ�飬����BΪ����ʯ���Լ�AΪ������ţ���
��ϡ���� ��Ũ���� ��NaOH��Һ ��Na2SiO3��Һ
��2��д��ͼ1��ƿ�з�����Ӧ�����ӷ���ʽ��
��3����ͬѧ����ʵ��ͼ1�ձ�������Ϊ��
��4����ͬѧ����ʵ��ͼ2��B��������Ϊ��
��5��д��ͼ2��A��������Ӧ�����ӷ���ʽ��
��6����ͬѧ��ͼ2�����ʵ����֤±�ص��������ԣ�Cl2��Br2��I2 �� ����Ϊ������������������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д����������ٹ��ˡ����������۳����������������ܹ�����ˮ����
A. �٢� B. �٢ڢ� C. �ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com