
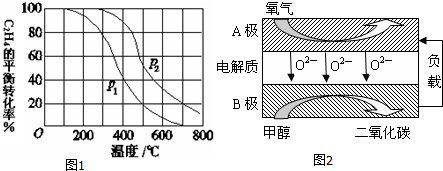
分析 由图象根据升温和增压分别判断C2H4的平衡转化率变化;
(1)提高乙烯的转化率,可以使平衡正向移动,但不能增加乙烯的量;
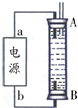
(2)①B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
②当A极消耗标况下1.12L O2,A电极为正极,水管做阴极,结合电子守恒计算阴极析出锌的质量.
解答 解:(a)由图象可知,升高温度,平衡逆向移动,C2H4的平衡转化率降低,
故答案为:其他条件相同,温度升高,C2H4的平衡转化率降低;
(b)反应C2H4 (g)+H2O(g)?C2H5OH(g)为气体体积减小的反应,增大压强,平衡正向移动,C2H4的平衡转化率增大,
故答案为:其他条件相同,增大压强,C2H4的平衡转化率增大;
(1)A.增大乙烯的浓度,乙烯的转化率减小,故A错误;
B.分离出乙醇,平衡正向移动,乙烯的转化率增大,故B正确;
C.加催化剂,不影响化学平衡,乙烯的转化率不变,故C错误;
故答案为:B;
(3)①B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:CH3OH+3O2--6e-=CO2+2H2O;
②当A极消耗标况下1.12L O2,物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,A电极为正极,电极反应,4OH--4e-=2H2O+O2↑,水管做阴极,Zn-2e-=Zn2+,结合电子守恒得到
O2↑~2Zn2+~4e-
0.05mol 0.1mol
水管增重的质量为 65g/mol×0.1mol=6.5g
故答案为:6.5.
点评 本题考查较综合,涉及化学平衡计算、化学平衡移动影响因素和电极反应式的书写及相关计算等,为高频考点,侧重分析能力及计算能力的考查,把握化学反应原理及图象、流程的分析为解答的关键,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3易溶于水形成胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都在1~1000 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
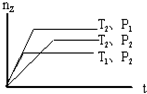 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,△H<0 | B. | T1<T2,P1>P2,△H>0 | ||
| C. | T1>T2,P1>P2,△H<0 | D. | T1>T2,P1<P2,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.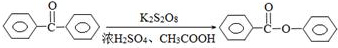
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com