
【题目】下列说法不正确的是( )
A.全降解塑料( )可由环氧丙烷(
)可由环氧丙烷(![]() )和
)和![]() 在一定条件下制得
在一定条件下制得
B.在淀粉水解液中先加入过量的氢氧化钠溶液、再滴入碘水,溶液未变蓝,说明淀粉已完全水解
C.除去乙酸乙酯中的少量水分,可以用无水硫酸钠但不能用碱石灰
D.福尔马林能用于制作标本主要是使蛋白质变性
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极、正极质量都增加
B.常温下,反应![]() 不能自发进行,则该反应的
不能自发进行,则该反应的![]()
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中![]() 、
、![]() 、
、![]() 的氧化性依次减弱
的氧化性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。
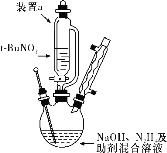
①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA
B.常温常压下,3.4g羟基(-OH)所含的电子数目为1.8NA
C.等物质的量的A1分别与足量盐酸和NaOH溶液反应,转移的电子数均为3NA
D.25℃时,1LpH=8的CH3COONa溶液中,水电离出的OH-数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2.0 L的密闭容器中发生反应:2SO2 + O2![]() 2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
(1)0~2 min内O2的平均反应速率v(O2)=_______________。
(2)该温度下此反应的化学平衡常数K=________________。
(3)在相同的温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0 molL-1,则此时反应速率v正________v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下:

请回答下列问题:
(1) Sb(ⅤA)最高正化合价为_____。
(2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成。
①该反应的离子方程式为____________________;
②如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。

(4) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。
(5) “脱锑”时发生的主要化学反应属于_________。
A.置换反应 B.氧化还原反应 C.非氧化还原反应
(6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)== CO2(g) ΔH=-283.0kJ/mol
②C(s)+O2(g)==CO2(g) ΔH=-393.5kJ/mol
请写出 C 与 O2 反应生成 CO 气体反应的热化学方程式: _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com