
����Ŀ��ClO2 ��һ�ָ�Ч��ȫ��ɱ�������������Ȼ��Ƶ�ⷨ����ClO2�Ĺ���ԭ��ʾ��ͼ����ͼ, �������ڵ������ClO2������˵����ȷ����
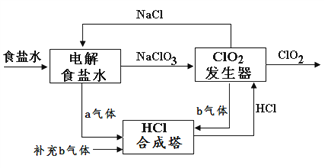
A. a������������b����������
B. �Ȼ��Ƶ�����ÿ����2 mol a���壬ת��2mol e-
C. ClO2�������������ĵ缫��ӦʽΪ��2ClO3- + 12H+ + 10e-![]() Cl2�� + 6H2O
Cl2�� + 6H2O
D. Ϊʹa��b����ǡ����ȫ��Ӧ��������ÿ����1molClO2��Ҫ����56L(��״��)b����
���𰸡�D
����������������ͼ��֪��������ΪNaClO3��HCl������ClO2������������ԭ��Ӧ��NaClO3����ԭ����ClO2��HCl����������Cl2��ͬʱ����ˮ����Ӧ�Ļ�ѧ����ʽΪ2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O��������b������������a����������A�����Ȼ��Ƶ�����ÿ����2 mol ������ת��4mol e-����B����ClO2�������������ĵ缫��ӦʽΪ��ClO3- + 2H+ + e-![]() ClO2�� + H2O����C������2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2Oÿ����1molClO2����Ҫ1mol NaClO3��ͬʱ����0.5 mol���������ݵ����غ��Ȼ��Ƶ�����ÿ����1mol NaClO3��ͬʱ����3 mol������Ϊʹa��b����ǡ����ȫ��Ӧ��������ÿ����1molClO2��Ҫ��������2.5 mol����D��ȷ��
ClO2�� + H2O����C������2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2Oÿ����1molClO2����Ҫ1mol NaClO3��ͬʱ����0.5 mol���������ݵ����غ��Ȼ��Ƶ�����ÿ����1mol NaClO3��ͬʱ����3 mol������Ϊʹa��b����ǡ����ȫ��Ӧ��������ÿ����1molClO2��Ҫ��������2.5 mol����D��ȷ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ǧ���ص�˵����ȷ����
A. �ڷŵ�ʱ�����������ķ�Ӧ��Pb��SO42-=PbSO4��2e��
B. �ڷŵ�ʱ���õ�صĸ���������Ǧ��
C. �ڳ��ʱ������������Ũ�Ȳ��ϱ�С
D. �ڳ��ʱ�����������ķ�Ӧ��PbSO4��2e��=Pb��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�����狀�����淋Ļ��Һa L�ֳ����ȷ���һ�ݼ��뺬b mol NaOH����Һ�����ȣ�ǡ�ð�NH3ȫ���ϳ�����һ��������c mol BaCl2����ʹSO42����ȫ��������ԭ��Һ��NO3�������ʵ���Ũ��Ϊ�� ��
A��![]() B��
B��![]() C��
C��![]() D��
D��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯��������������������������ء���ش��������⣺
��1������CO�Ĵ��ڻ����������д����ж�������SO2����CO����������ԭΪS��
��֪���� Cc(s)+ 1/2O2 (g)=CO (g) ��H1=-l26.4kJ��mol-1
�ڢ�C(s)+O2 (g) =CO2 (g) ��H2=-393.5kJ��mol-1
@S(s)+O2 (g)=SO2 (g) ��H3=-296.8kJ��mol-1
��SO2����CO���Ȼ�ѧ��Ӧ����ʽ__________________��
(2) CO�����ںϳɼ״�����Ӧ����ʽCO(g)+2H2(g)![]() CH3OH(g)��
CH3OH(g)��

�� COת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H_______0 (�>����<��)
ͼ2������I��II��III��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3�������ǵĴ�С��ϵΪ___________�����B(x��60)��������ת����Ϊ40%����x=___________��
��һ�������£���2molCO��2molH2�����ݻ�Ϊ2L�̶����ܱ������з���������Ӧ���ﵽƽ��ʱ��CO��H2���֮��Ϊ2:1����ƽ�ⳣ��K=___________��
(3)������Ũ����ȩ��ˮ��ԭ����2CH3CHO+H2O![]() CH3CH2OH+CH3COOH��ʹ�ö��Ե缫��⣬��һ��Ũ�ȵ�CH3CHO �CNa2SO4��ҺΪ���ؠ��Һģ�ҵ��������װ����ͼ3��ʾ��
CH3CH2OH+CH3COOH��ʹ�ö��Ե缫��⣬��һ��Ũ�ȵ�CH3CHO �CNa2SO4��ҺΪ���ؠ��Һģ�ҵ��������װ����ͼ3��ʾ��
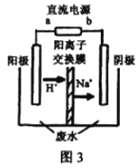
�ٵ������У��������ֱ�����������Ҵ��⣬��������ɫ���壬�����缫��Ӧ�ֱ�4OH- -4e-=O2��+2H2O��__________________��
����ʵ�ʴ��ֹ����У���������ȩ��ȥ���ʿɴ�60%�������������ֱ�ע��lm3��ȩ�ĺ���Ϊ300mg L-1�ķ�ˮ,�ɵõ��Ҵ�_______ kg(�������2λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȡ������жϲ���ȷ����
![]()
A. �����̬�⻯������ȶ��ԣ�R��Q
B. ����������Ӧˮ��������ԣ�Q��W
C. ԭ�Ӱ뾶��T��Q��R
D. ��T������Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��л���ն���(Cu2SO3��CuSO3��2H2O)��һ�����ɫ���壬������ˮ���Ҵ���100��ʱ�����ֽ⡣����CuSO4��5H2O��SO2��Ϊԭ���Ʊ���ʵ��װ������ͼ��ʾ��
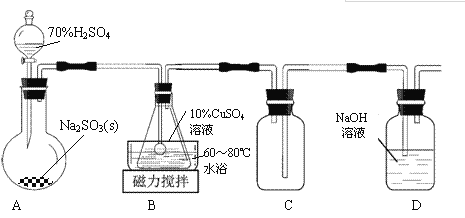
��1��װ��A�ڳ�������ȡSO2ʱ���ý�Ũ�����������ϡ���ᣬ��ԭ����_______________��
��2��װ��B�з�����Ӧ�����ӷ���ʽΪ_______________��
��3��װ��C��������____________________��
��4����B�л�õĹ�������������ˮ���ϴ�ӣ�����ո��
�ټ���ϴ������ȫ�ķ�����__________________��
�ڲ��ú�ɵķ�ʽ�õ���Ʒ����ԭ����________________��
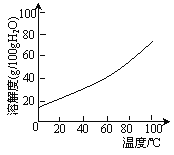
��5���벹�������ɹ�ҵ������ͭ��������FeO���Ʊ�ʵ��ԭ�ϣ�����CuSO4��5H2O����ʵ�鷽������ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬_______________�����ˣ���95%�ƾ�ϴ�Ӿ���2~3�Σ����ɣ��õ�CuSO4��5H2O��
[��֪���ٸ���Һ���������↑ʼ�����������ȫʱ��pH��Χ�ֱ�Ϊ��Fe(OH)2��5.8��8.8����Cu(OH)2��4.2��6.7����Fe(OH)3��1.1��3.2��������ˮ��Һ�г���100�棬����ͭ������ʧȥ�ᾧˮ��������ͭ�����ܽ����������ͼ��ʾ]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧ��ʵ�飬���ܴﵽʵ��Ŀ���ǣ�������
A | B | C | D | |
װ�� |
|
|
|
|
ʵ�� | �����������Ƚ�п�벻ͬŨ�ȵ�ϡ���ᷴӦ�Ŀ��� | ֤���¶ȶԻ�ѧƽ���Ӱ�� | ��֤��������������ʴ | ��֤���ǽ����� C��Si |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1994���ŵ������ѧ������Ϊ�о�������������Ļ�ѧ�ҡ�O���������к������ߣ�����������������Ŀռ䡣O�����ӵĽṹ��ͼ����V�ͣ�����116��5�档����ԭ����һ��Oԭ��Ϊ���ģ�����������Oԭ�ӷֱ�һ���Ǽ��Թ��ۼ����м�Oԭ���ṩ2�����ӣ��Ա�����Oԭ�Ӹ��ṩ1�����ӣ�����һ������Ļ�ѧ����������Oԭ�Ӿ��ȵ�������4�����ӡ���ش�
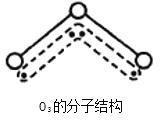
��1��ѡ�����з�����O�����ӵĽṹ�����Ƶĵ���___________��
A. H��O B��CO�� C��SO�� D��BeCl��
��2��������ijԭ����1��û�и�����ԭ�ӹ��õļ۵��ӽй¶Ե��ӣ���ôO��������___________�Թ¶Ե��ӡ�
��3��O��������_____________���ӣ���Ի�Ǽ��ԣ���
��4��O�� ��ʹ���۵⻯����ֽ����2KI��O3��H2O===2KOH��I2��O2����������ͻ�ԭ��������ʵ���֮��Ϊ____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����п���KMnO4����ȡ������KMnO4����Ԫ�صĻ��ϼ�Ϊ
A. +7 B. +5 C. +3 D. -7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com