
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用。下列说法正确的是
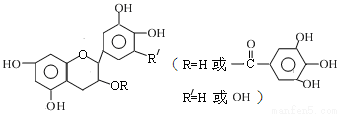
A.常温下,儿茶素不溶于水,也不溶于有机溶剂
B.儿茶素能与FeCl3溶液发生显色反应
C.1 mol儿茶素最多可与9mol NaOH反应
D.儿茶素一定不能发生水解反应
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列化学用语对应正确的是
A.CH4分子的比例模型: B.CCl4的电子式:
B.CCl4的电子式:
C.H2O2的结构式:H-O-O-H D.乙酸的最简式:C2H4O2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
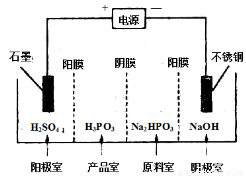
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl-
C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32-
D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:推断题
(15分)化合物莫沙朵林(F)是一种镇痛药,它的合成路线如下(其中的THF是有关反应的催化剂):
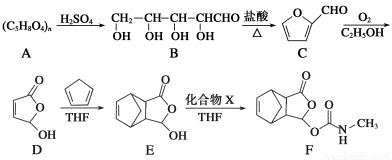
(1)化合物C中的含氧官能团的名称为 、 。化合物E的分子中含有的手性碳原子数为 。1 mol F最多可与 mol NaOH反应。
(2)化合物C与新制氢氧化铜的悬浊液反应的化学方程式为 。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.分子的核磁共振氢谱图(1H核磁共振谱图)中有4个峰;Ⅱ.能发生银镜反应和水解反应;Ⅲ.能与FeCl3溶液发生显色反应,且与溴水反应。
(4)已知E+X→F为加成反应,则化合物X的结构简式为 。
 (5)已知:
(5)已知: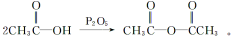 化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
和1,3—丁二烯为原料制备G的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温常压下,32 g 甲醇中含有的C—H键的数目为4NA
B.标准状况下,11.2 L 甲醛中含有的电子数目为8NA
C.0.1 mol N2与0.3 mol H2在一定条件下充分反应,生成的氨分子数目为0.2NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:实验题
[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为:
 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→ +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:

步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,不能达到实验目的的是( )

A. 图1所示装置可制备氢氧化亚铁
B. 图2所示装置可电解食盐水制氯气和氢气
C. 图3所示装置可验证氨气极易溶于水
D. 图4所示装置与操作可除去苯中的苯酚
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
有关下列各组热化学方程式中关系说法正确的是
2H2(g)+O2(g)=2H2O(g); △H1 = -Q1kJ/mol
2H2(g)+O2(g)=2H2O(1); △H2 = -Q2kJ/mol
H2(g)+1/2O2(g)=H2O(1);△H3 = -Q3kJ/mol
A.△H1=△H2 B.△H1<△H2 C. Q1 >2Q3 D.△H1>2△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com