汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N
2(g)+2CO
2(g),请回答下列问题:
(1)已知:N
2(g)+O
2(g)=2NO(g)△H=+180.5kJ?mol
-lC(s)+O
2(g)=CO
2(g)△H=-393.5 kJ?mol
-l2C(s)+O
2(g)=2CO(g)△H=-221kJ?mol
-l则2NO(g)+2CO(g)?N
2(g)+2CO
2(g) 的△H=
kJ?mol
-l.
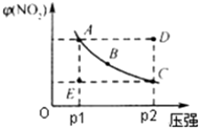
(2)一定温度下,向体积为 1L的密闭容器中充入一定量的NO和CO.在t
1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N
2)=a mol,且N
2占平衡总体积的
.
①则该反应的平衡常数K=
.若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N
2、0.2mol的NO,平衡将
移动(填“向左”、“向右”或“不”).
②下列各种情况,可说明该反应已经达到平衡的是
.
A.v生成(CO
2)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.NO、CO、N
2、CO
2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
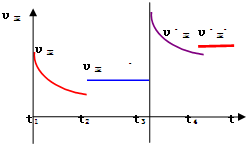
③在t
2时刻,将容器迅速压缩到原容积的
,在其它条件不变的情况下,t
3时刻达到新的平衡状态.请在图1中补充画出t
2-t
3-t
4时段,正反应速率的变化曲线:
(3)如果要净化汽车尾气的同时提高该反应的速率和NO的转化率,采取的措施是
;
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N
2 D.及时将CO
2和N
2从反应体系中移走
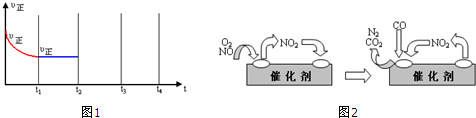
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.
①写出上述变化中的总化学反应方程式
.
②有人提出,可以设计反应2CO(g)=2C(s)+O
2(g) 来消除CO的污染.请你判断是否可行,并说出理由:
.


 ,故答案为:
,故答案为: ;
;