
| A、X>Y>Z |
| B、Z>Y>X |
| C、Y>X>Z |
| D、X>Z>Y |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
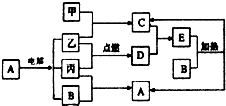 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、SO2的消耗速率等于SO3的生成速率 |
| B、SO2的生成速率等于SO3的生成速率 |
| C、SO2的消耗速率大于O2生成速率的2倍 |
| D、SO3的生成速率等于O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
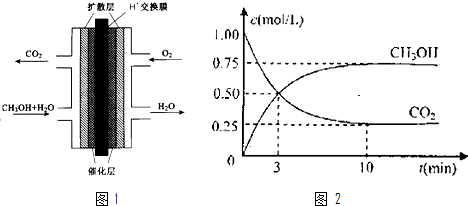
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 |
| B、稀醋酸与0.1 mol?L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| C、已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热△H=-110.5 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
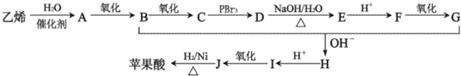
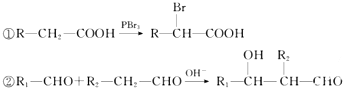
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com