
����Ŀ����������泥�(NH4)2SO4��FeSO4��6H2O���׳�Ī���Σ���dz��ɫ���壬������ˮ����100�桫110��ʱ�ֽ⣬���������������еı��Լ���ij��ѧС���Է���мΪԭ����ʵ�����н���ʵ��̽�������Ʊ���������鱗������䴿�ȣ���������:
I.�Ʊ����������
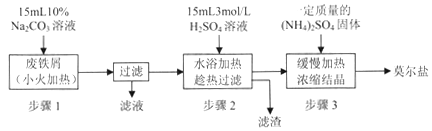
��ش��������⣺
(1)����l��������_________���������ӷ���ʽ����Ҫ������˵������
(2)����2������������������Ҳ��˵ȵ���м��ȫ��Ӧ��Ź��ˣ������̺��ĵ�����_______________��
II.�ⶨ��������淋Ĵ���
��ȡmgʵ�����Ʊ��������������Ʒ�����500ml��Һ��ȡ25. 00mL������������Һ����0 . 1mol/L������KMnO4��Һ���еζ������ظ��ζ����Ρ�
(3)����(NH4)2SO4��FeSO4��Һ���õ�����ˮ��ͨ����������һ��ʱ�����ȴ��������ʹ�ã����������ĺô���___________________��
(4)�ζ�ʱ������Ӧ�����ӷ���ʽΪ___________________��
(5)�ζ��յ�ʱ������Ϊ ___________________��
(6)���εζ��������KMnO4��Һ������ƽ��ֵΪVmL���������������Ʒ�Ĵ���Ϊ__________��
(7)��ѧС������������ּ�ⴿ�ȵķ�������ȷ��Ŀǰ��������������Ⱦ�ķ����ж���,��������������һ�ּ�ⷽ��________________��
���𰸡�Na2CO3��Һˮ���Լ��Ա��ڳ�ȥ��м��������ۣ�CO32-+H2OHCO3-+OH-�������������Fe2+ˮ�⣬��Ӧδ����ʱ������м�ɷ�ֹFe2+������ȥˮ�е���������ֹFe2+������MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O�������һ��KMnO4��Һʱ����ƿ����Һ��Ϊ��ɫ����30s�ڲ���ȥ![]() ��100%ͨ���ⶨSO42-�����ʵ�����NH4+�����ʵ�����������������淋���
��100%ͨ���ⶨSO42-�����ʵ�����NH4+�����ʵ�����������������淋���
������������м��̼������Һ��ϴ�ӳ�ȥ��������ۣ�С�������������������ϴ����м������ϡ������Һˮԡ���ȡ����ȹ��ˣ��õ���Һ�м���һ��������粒��壬��Һ������־�Ĥʱ��ֹͣ���ȣ�����ʱ��Һ�е��������ӻᱻ���뾧���У��¶ȹ��߾���ֽⱻ������������������ȡ����Ũ������ȴ�ᾧ������ͨ����ѹ����(�����)�ȵõ���Ϊ����ľ��塣
(1)Na2CO3��Һ��CO32-ˮ��CO32-+H2OHCO3-+OH-��ʹNa2CO3��Һ�ʼ��ԣ�Na2CO3����Ҫ�����dz�ȥ��м��������ۣ��ʴ�Ϊ��Na2CO3��Һˮ���Լ��Ա��ڳ�ȥ��м��������ۣ�CO32-+H2OHCO3-+OH-��(2)��������ˮ��ķ���ʽ�ǣ�Fe2++2H2OFe(OH)2+2H+������������Һ�е������ӻ�����Fe2+��ˮ�⣬Fe2+�ױ�����ΪFe3+��������Fe3+��Fe������ӦFe+2Fe3+=3Fe2+����Ӧδ����ʱ������м�ɷ�ֹFe2+������ΪFe3+���ʴ�Ϊ���������������Fe2+ˮ�⣬��Ӧδ����ʱ������м�ɷ�ֹFe2+������(3)ˮ������һ�����������������������ԣ�(NH4)2Fe(SO4)2��Һ�к����������ӣ�Fe2+�ױ�����������(NH4)2Fe(SO4)2��Һ���õ�����ˮ��ͨ����������һ��ʱ�����ȴ��������ʹ�ã����������ɳ�ȥˮ�е���������ֹFe2+���������ʴ�Ϊ����ȥˮ�е���������ֹFe2+��������(4)���������Fe2+�ķ�Ӧ��MnO4-��Mn2+��5e-��Fe2+��Fe3+��e-�����ݵ����غ㣬�����Ӻ���������ǰ��5������ԭ���غ�͵���غ�õ���Ӧ�����ӷ���ʽΪ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O���ʴ�Ϊ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��(5)MnO4-Ϊ��ɫ���ζ��յ�ʱ���������һ�����Ը��������Һ����ɫ����ȥ����Һ����ɫ����ɫ��30s���ޱ仯��˵���ζ����յ㣬�ʴ�Ϊ���������һ��KMnO4��Һʱ����ƿ����Һ��Ϊ��ɫ����30s�ڲ���ȥ��(6)���εζ��������KMnO4��Һ������ƽ��ֵΪVmL������KMnO4�����ʵ���ΪV��10-3L��0.1000molL-1=V��10-4mol��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��n(Fe2+)=5V��10-4mol����(NH4)2SO4FeSO46H2O������Ϊ5V��10-4mol��392g/moL�������������Ʒ�Ĵ���Ϊ![]() ��100%=
��100%=![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ��![]() ��100%��(7)���������ױ�������ͨ�������������IJⶨ������(NH4)2SO4FeSO46H2O�����ʵ�����ȷ������������Ӳ���������笠���������Һ��Ҳ���ױ�����������ͨ���ⶨ��������ӵ����ʵ�����笠����ӵ����ʵ�����������������淋������ʴ�Ϊ��ͨ���ⶨ��������ӵ����ʵ�����笠����ӵ����ʵ�����������������淋�����
��100%��(7)���������ױ�������ͨ�������������IJⶨ������(NH4)2SO4FeSO46H2O�����ʵ�����ȷ������������Ӳ���������笠���������Һ��Ҳ���ױ�����������ͨ���ⶨ��������ӵ����ʵ�����笠����ӵ����ʵ�����������������淋������ʴ�Ϊ��ͨ���ⶨ��������ӵ����ʵ�����笠����ӵ����ʵ�����������������淋�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijpH = l����ɫ����Һ�У��ܴ����������
A. Na+��NO3-��I- B. K+��AlO2-��Cl-
C. Cu2+��SO42-��NO3- D. NH4+��SO42-��Br-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ����������У������õİ�ȫ��ʩ��ȷ���ǣ� ��
A. ���ܶ�̽�մ������� B. �Ϳ�������ǰ���еƻ�ʵ��
C. ��ȼľ�����ú���Ƿ�й© D. ��СúҤ��ú�û������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NOx���Ǵ�����Ҫ��Ⱦ��֮һ����������·�����ѡ�ûش���Ӧ���⣺
I.����CH4����ԭ�����������������������Ⱦ����֪��
��CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) ��H=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) ��H=-662kJ/mol
��CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l) ��H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) ��H=-955kJ/mol
���Т�ʽ��ƽ�ⳣ��ΪK1����ʽ��ƽ�ⳣ��ΪK2����(1) CH4 (g)+4NO (g��=2N2(g) + CO2 (g )+H2O ��1����H=_________ ���ķ�Ӧ��ƽ�ⳣ��K=_________���ú�Kl��K2�Ĵ���ʽ��ʾ����
II����ȼ�ϵ�ص�ԭ������������������һ���·���װ����ͼ��ʾ���ڴ���������ʯī�缫I�Ϸ�Ӧ����һ��������Y��

(2��д��������Y�Ļ�ѧʽ_____________��
(3)ʯīII�缫Ϊ______������������������õ缫��ӦΪ______________��
��.���û���̿��ԭ��������������йط�ӦΪC(s)+2NO(g)![]() N2(g)+ CO2(g) ��H=akJ/mol��ij�о�С����ij�����ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����֪�ڲ�ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+ CO2(g) ��H=akJ/mol��ij�о�С����ij�����ܱ������м���һ�����Ļ���̿��NO�����£�T1�棩�����·�Ӧ����֪�ڲ�ͬʱ���ø����ʵ�Ũ�����£�

��4���÷�Ӧ��ƽ�ⳣ������ʽK=_______����0��10s�ڣ�N2��ƽ����Ӧ����Ϊ______mol/(L��s)��NO��ת����Ϊ________��
��5��30s�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������________����30s�������¶���T2�棬ƽ��ʱ��������NO��Ũ����0.060mol/L��Ϊ0.072mol/L����÷�Ӧ��a___0 ���>������<����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ʯ������Ϊȼ�������ձ������м�ͥ�����Ǻ����������ʵĻ�������ڳ�ѹ������Щ���ʵķе����±���ʾ��
�������� | ���� | ���� | ���� | ���� | ���� |
�е�/�� | ��88.6 | ��42.1 | ��0.5 | 36.1 | 69.2 |
�ڳ�����ʹ����������ų�ʱ����ƿ�г�ʣ��һЩҺ̬��������Щ�������п�����(����)
A. ���顢����Ͷ��� B. ����ͱ���
C. ֻ������ D. ����ͼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��150��ʱ��NO2����ʽ�����ֽⷴӦ2NO2![]() 2NO+O2 ��H��0�����ݻ�Ϊ1L���ܱ������м���0.05molNO2��150��ʱ��ַ�Ӧ���ﵽƽ�����c(NO)=0.04mol/L����������akJ��
2NO+O2 ��H��0�����ݻ�Ϊ1L���ܱ������м���0.05molNO2��150��ʱ��ַ�Ӧ���ﵽƽ�����c(NO)=0.04mol/L����������akJ��
��1����˵��������Ӧ�Ѿ��ﵽ��ѧƽ��״̬���� ��
A���������������ɫ���ٱ仯
B��������ѹǿ���ٱ仯
C��������������ܶ����ٱ仯
D�������������ƽ��Ħ���������ٱ仯
E��v��(NO2)=v��(NO)
F����ͬʱ����ÿ����2��NO2���ӵ�ͬʱ������2��NO����
��2�������йظ÷�Ӧ��ͼ������ȷ���� ��




��3�����ӷ�Ӧ��ʼ��c(NO)=0.04mol/L����ʱ5���ӣ�����O2��ʾ��ƽ����Ӧ����Ϊ ��
��4��150��ʱ������Ӧ��ƽ�ⳣ����ֵΪ (�ɲ�д��λ)��
��5��������ͬ�������ڿ�ʼʱֻ����0.05molNO��0.025molO2������ͬ���¶��³�ַ�Ӧ�ﵽƽ���ǡ�÷ų�akJ�����������ʱO2��ת����Ϊ ��
��6�����������������д�ʩ����ʹn(NO2)/ n(NO)������� ��
A�������¶� B������He��
C���ٳ���1 mol NO (g)��0.5 mol O2(g) D��ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ�У���Ҫ�����ʵ����������ǣ� ��
A.HCl��Cl2
B.MnO4��Mn2+
C.SO3��SO42��
D.CO2��CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����˵��SO2����Ư���Ե��ǣ� ��
A.SO2 ��ʹ��ˮ��ɫ
B.SO2��ʹƷ����Һ��ɫ
C.SO2��ʹ��ˮ��ɫ
D.SO2 ��ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������µĿ��淴Ӧ��X(g)��2Y(g)![]() 2Z(g) �ֽ�X��Y��1�U2������Ȼ�����ܱ������У���ѹ��3��107Pa���ﵽƽ�����֪ƽ��״̬ʱ��Ӧ��������ʵ�����������������ʵ������ʱ����Ӧͼ�������ϵ��¶���( )
2Z(g) �ֽ�X��Y��1�U2������Ȼ�����ܱ������У���ѹ��3��107Pa���ﵽƽ�����֪ƽ��״̬ʱ��Ӧ��������ʵ�����������������ʵ������ʱ����Ӧͼ�������ϵ��¶���( )

A�� 100�� B�� 200�� C�� 300�� D�� ����ȷ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com