
| A、摩尔是7个基本物理量之一 |
| B、18 g水在标准状况下的体积约为22.4 L |
| C、27 g Al约含有6.02×1023个铝原子 |
| D、配制0.1 mol/L的NaCl溶液需NaCl固体的质量为5.85 g |
| 27g |
| 27g/mol |
| 27g |
| 27g/mol |


科目:高中化学 来源: 题型:
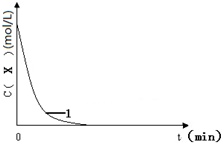 已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01 mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
| 气化炉中产生H2 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.6kJ mol-1 ②CO(g)+H2O(g)═CO2(g)+H2(g) △H=-41.2kJ mol-1 ③CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C、煤油可由石油分馏获得,可用于保存少量金属钠 |
| D、工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
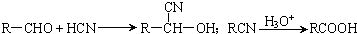 .
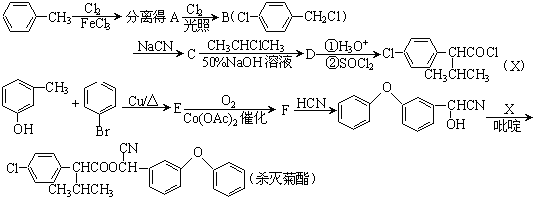
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com