
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.分析 (1)根据盖斯定律来分析;
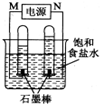
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子;
②电解饱和食盐水时,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,2H++2e-═H2↑,根据氢氧化钠与氢气的关系式计算出溶液中的氢氧根离子、氢离子的浓度,然后计算出溶液的pH.
解答 解:(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ•mol-1
根据盖斯定律可知:将①-②可得:CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=(-393.5kJ•mol-1)-(+131.3kJ•mol-1)=-524.8KJ/mol,
故答案为:-524.8KJ/mol;
(2)①由图可知:电解饱和食盐水,阴极生成氢气,阳极生成氯气,氯气易溶于水,体积较小,则右端为阳极,所以N为原电池的正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
②电极饱和食盐水,阴极发生了反应:2H++2e-═H2↑,由2NaOH~H2↑,阴极得到11.2mL标准状况下的气体,则n(OH-)=$\frac{0.0112L}{22.4L/mol}$×2=0.001mol,
溶液中c(OH-)=$\frac{0.001mol}{1L}$=0.001mol/L,c(H+)=$\frac{1{0}^{-14}}{0.001}$mol/L=1×10-11mol/L,
所以pH=11,
故答案为:11.
点评 本题考查了盖斯定律的应用、原电池原理和电解池原理的应用、反应速率的计算和影响平衡的因素等,题目综合性强,难道较大,侧重于考查学生对基础知识的综合应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
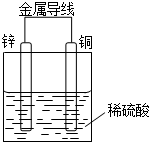 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X的氢化物沸点一定低于Y的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
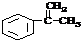 .
.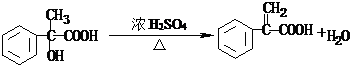 .
.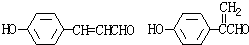 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素形成离子后,最外层电子达到都达到8电子稳定结构 | |
| B. | 所有主族元素的正化合价数等于它的族序数 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 第4周期由左至右第8、9、10三列中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
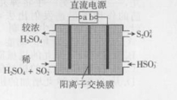 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com