
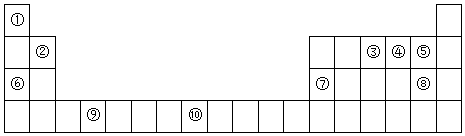
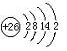 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
分析 由元素在周期表中位置,可知①为C、②为Be、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为Cl、⑨为Ti、⑩为Fe;
(1)Fe的原子序数为26;
(2)非金属性越强,电负性越大;具有相同电子排布的离子中原子序数大的离子半径小;非金属性越强,对应氢化物越稳定;
(3)元素②的最高价氧化物与NaOH溶液反应,类似氧化铝与NaOH的反应;
(4)Q的电离能较大,且其第一电离能较大,应该为稀有气体元素;
R第一电离能远远小于第二电离能,则R元素原子最外层电子数为1,属于第IA族元素;
S第二电离能远远小于第三电离能,则S元素原子最外层电子数是2,属于第IIA族元素;
T元素第三电离能远远小于第四电离能,则T元素原子最外层电子数是3,属于第IIIA族元素;
U元素第一电离能远远小于第二电离能,则U元素原子最外层电子数是1,属于第IA族元素,
R第一电离能大于U,则原子序数R小于U;
(5)结合均摊法及电子对互斥模型来解答.
解答 解:(1)Fe原子结构示意图为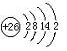 ,故答案为:
,故答案为: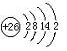 ;
;
(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N,其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF,
故答案为:F>O>N;N3->O2->F-;HF;
(3)元素②的最高价氧化物与NaOH溶液反应的离子方程式为2OH-+BeO=BeO22-+H2O,故答案为:2OH-+BeO=BeO22-+H2O;
(4)①若以上五种元素为前四周期元素,R和U属于第IA族元素,R第一电离能大于U,则原子序数R小于U,则R为Na,故答案为:R 和U;
②若五种元素为主族元素,T属于第IIIA族元素,则T为p区元素,若T为第三周期元素,T为Al元素,E是第三周期元素中原子半径最小的元素,则为Cl元素,T、E形成化合物为AlCl3,AlCl3中Al原子价层电子对个数是3且不含孤电子对,所以其空间构型为平面三角形,键角为 120°,
故答案为:p; 120°;
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有硅原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,金刚砂中碳原子和硅原子个数之比为1:1,所以该晶胞中碳原子个数是4,每个硅原子连接4个C-Si键,所以硅原子的杂化方式为sp3,
故答案为:4;4;sp3.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意(5)中计算为解答的难点,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
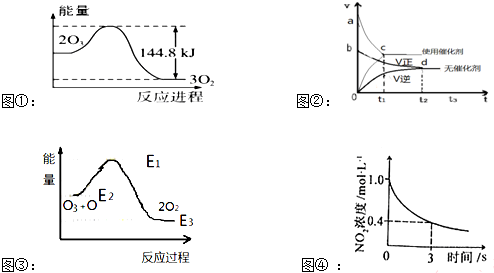
| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
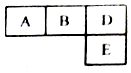 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径大小顺序为:W>Z>R | |
| B. | X2Z2的电子式为: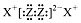 | |
| C. | X2Z的沸点比X2W的沸点高 | |
| D. | Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
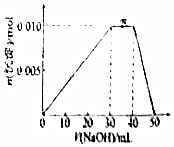
| A. | 当加入50mLNaOH时,溶液中的溶质为NaAlO2 | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 若向NH4Al(SO4)2溶液改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤水点豆腐、明矾净水的原理都是破坏胶体的介稳性 | |
| B. | 铁、铝、铜制容器放置空气中都能在表面形成致密氧化物 | |
| C. | 单晶Ge是半导体,可以作为光电转换材料用于太阳能电池 | |
| D. | 检测酒后驾车者呼出气中的乙醇属于化学检测方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com