
 已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.
已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.  名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
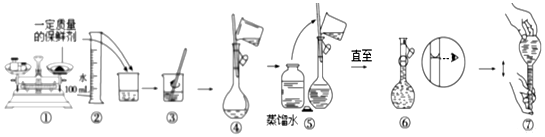
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
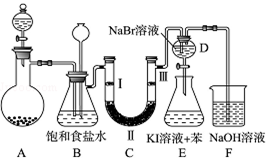
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
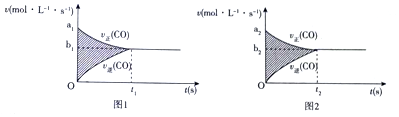
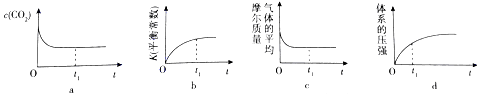
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

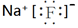 .
.查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列实验方法或装置正确的是( )

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com