
【题目】下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气中还是纯氧中都不会燃烧
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g)![]() 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是

A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g) △H=+Q kJ·mol,下图为该反应在不同初始浓度的N2和不同催化剂I、Ⅱ作用下(其他条 件相同),体积为2L的密闭容器中n(NH3)随反应时间的变化曲线,下列说法正确的是
4NH3(g)+3O2(g) △H=+Q kJ·mol,下图为该反应在不同初始浓度的N2和不同催化剂I、Ⅱ作用下(其他条 件相同),体积为2L的密闭容器中n(NH3)随反应时间的变化曲线,下列说法正确的是

A. 0~6h内,催化剂I的催化效果比催化剂Ⅱ的好
B. a点时,催化剂I、Ⅱ作用下N2的转化率相等
C. 0~5h内,在催化剂I的作用下,O2的反应速率为0.12mol/(L·h)
D. 0~12h内,催化剂Ⅱ作用下反应吸收的热量比催化剂I的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH的变化关系如右图所示。下列说法错误的是( )
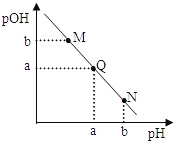
A. 此温度下,水的离子积常数为1.0×10 -2a
B. N点溶液加水稀释,![]() 增大
增大
C. M、Q、N三点所示的溶液中,c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D. Q点消耗的盐酸的体积等于氨水的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸盐在地壳中分布很广,可用蛭石生产硫酸镁和氢氧化镁。某地蛭石的主要成分是[(Mg2.36Fe0.48Al0.16)(Si2.72Al1.28)O10(OH)2] ·[Mg0.32(H2O)0.42],还含有少量杂质FeO。
实验步骤如下:
Ⅰ.制取粗硫酸镁:用硫酸浸泡蛭石矿粉,过滤,将滤液结晶得到粗硫酸镁。
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol·L—1H2O2溶液,再加试剂A调节溶液pH,并分离提纯。
Ⅲ.制取氢氧化镁:向步骤Ⅱ得的溶液中加入过量氨水。
一些金属离子转化为氢氧化物沉淀时溶液的pH如表1所示
表1
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)在步骤Ⅱ中加H2O2溶液的目的是___________。调节溶液pH的范围是______________。试剂A的最佳选择是_________(填字母序号)。
A、MgO B、Na2CO3 C、蒸馏水 D、稀硫酸
(2)测定粗硫酸镁中Fe2+的含量。称取12.3g粗硫酸镁样品溶于水形成溶液,完全转移到锥形瓶中,加稀硫酸酸化,滴加几滴黄色铁氰化钾K3[Fe(CN)6]溶液,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如表2所示。
表2
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 12.49 | 12.50 | 13.62 | 12.51 |
①K3[Fe(CN)6]与Fe2+反应生成带有特征蓝色的铁氰化亚铁沉淀,请写出反应的离子方程:________。
②反应达到终点时的标志是_________________________________________________。
③根据表2数据,可计算出粗硫酸镁样品中含有Fe2+_______________mol。
(3)工业上常以Mg2+的转化率为考查指标来确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件。
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为_________________________。
②已知25℃时,Mg(OH)2和Ca(OH)2的Ksp分别为2×10-11和4.7×10—6。若用石灰乳替代氨水,__________(填“能”或“不能”)制氢氧化镁,理由是_____________________________。
③通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,Mg2+完全沉淀时溶液的pH为________。(保留小数点后一位)(已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com