
”¾ĢāÄæ”æĒė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŅŃÖŖ£ŗN2”¢O2·Ö×ÓÖŠ»Æѧ¼üµÄ¼üÄÜ·Ö±šŹĒ946kJ”¤mol-1”¢497 kJ”¤mol-1.
N2(g)+O2(g)=2NO(g) ”÷H=+180.0kJ”¤mol-1”£ŌņĻąĶ¬Ģõ¼žĻĀĘĘ»µ1mol NO·Ö×ÓÖŠµÄ»Æѧ¼üŠčŅŖĪüŹÕµÄÄÜĮæĪŖ_______kJ”£
(2)25”ꏱ£¬pH=5µÄCH3COOHČÜŅŗÖŠ£®ÓÉĖ®µēĄė³öµÄĒāĄė×ÓÅضČc(H+)=________ kJ”¤mol-1£»ĶłČÜŅŗÖŠ¼ÓČėÉŁĮæNaOH¹ĢĢ壬ŌņČÜŅŗÖŠ![]() _______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£¬Š“³ö±ķŹ¾øĆ»ģŗĻČÜŅŗÖŠĖłÓŠĄė×ÓÅضČÖ®¼äµÄŅ»øöµČŹ½£ŗ_________________”£
_______(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£¬Š“³ö±ķŹ¾øĆ»ģŗĻČÜŅŗÖŠĖłÓŠĄė×ÓÅضČÖ®¼äµÄŅ»øöµČŹ½£ŗ_________________”£
(3)25”ęĻĀ£¬ĻņijNa2CO3ČÜŅŗÖŠ¼ÓČėĻ”ŃĪĖį£¬ĘäÖŠŗ¬Ģ¼ŌŖĖŲµÄø÷ÖÖĪ¢Į£ĪļÖŹµÄĮæ·ÖŹż(¦Õ)ĖęČÜŅŗpH±ä»ÆµÄ²æ·ÖĒéæöČēĶ¼ĖłŹ¾”£
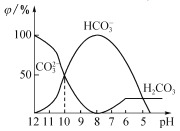
¢ŁŌŚĶ¬Ņ»ČÜŅŗÖŠ,H2CO3”¢HCO3-”¢CO32-______(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)“óĮæ¹²“ę”£
¢Śµ±pH =7Ź±,ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄĪ¢Į£Ö÷ŅŖĪŖ________”£ČÜŅŗÖŠø÷ÖÖĄė×ÓµÄĪļÖŹµÄĮæÅØ¶Č“óŠ”¹ŲĻµĪŖ______________”£
¢Ū·“Ó¦µÄCO32-+H2O![]() HCO3-+OH-µÄĘ½ŗā³£ŹżKh=______________________”£
HCO3-+OH-µÄĘ½ŗā³£ŹżKh=______________________”£
”¾“š°ø”æ631.5 10-9 ²»±ä c(CH3COO-)+c(OH-)=c(Na+)+c(H+) ²»ÄÜ HCO3- c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10-4
”¾½āĪö”æ
£Ø1£©¾É¼ü¶ĻĮŃĪüŹÕµÄÄÜĮæ¼õČ„ŠĀ¼üÉś³ÉŹĶ·ÅµÄÄÜĮæÖµ¼“ĪŖ·“Ó¦ČČ£»
£Ø2£©ČÜŅŗÖŠpH=-lgc£ØH+£©£¬CH3COOHĪŖĖį£¬Ė®µēĄė³öµÄc£ØH+£©µČÓŚČÜŅŗÖŠc£ØOH-£©£»ĶłČÜŅŗÖŠ¼ÓČėÉŁĮæNaOH¹ĢĢ壬·“Ӧɜ³É“×ĖįÄĘ£¬ČÜŅŗÖŠc(CH3COOH)/ c(CH3COO-) c(H+)=1/Ka£¬ĪĀ¶Č²»±äµēĄėĘ½ŗā³£Źż²»±ä£¬ČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£»
£Ø3£©³£ĪĀĻĀŌŚ20mL0.1mol/L Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1mol/L HClČÜŅŗ40mL£¬ĻČ·“Ӧɜ³ÉĢ¼ĖįĒāÄĘ£¬ŌŁÓėŃĪĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼”¢Ė®”£
¢Łøł¾ŻĶ¼2æÉÖŖ£¬pH=8Ź±Ö»ÓŠĢ¼ĖįĒāøłĄė×Ó£¬pH“óÓŚ8Ź±“ęŌŚĢ¼ĖįøłĄė×ÓŗĶĢ¼ĖįĒāøłĄė×ÓĄė×Ó£¬pHŠ”ÓŚ8Ź±“ęŌŚĢ¼ĖįŗĶĢ¼ĖįĒāøłĄė×Ó£¬ŌŚĶ¬Ņ»ČÜŅŗÖŠ£¬H2CO3”¢HCO3-”¢CO32-²»Äܹ²“ę£»
¢ŚpH=7Ź±£¬ČÜŅŗÖŠČÜÖŹĪŖĢ¼ĖįĒāÄĘ”¢ĀČ»ÆÄĘ¼°Ģ¼Ėį£¬ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄĪ¢Į£Ö÷ŅŖĪŖHCO3-£»ČÜŅŗĻŌŹ¾ÖŠŠŌ£¬c£ØH+£©=c£ØOH-£©£¬øł¾ŻµēŗÉŹŲŗćÅŠ¶ĻČÜŅŗÖŠø÷Ąė×ÓÅØ¶Č“óŠ”¹ŲĻµ£»
¢Ūµ±ČÜŅŗÖŠc£ØHCO3-£©£ŗc£ØCO32-£©=1£ŗ1Ź±£¬Ķ¼ĻóæÉÖŖPH=10£¬c£ØH+£©=10-10mol/L£¬ÓÉKwæÉÖŖc£ØOH-£©=10-4mol/L£¬¾Ż“Ė¼ĘĖćĖ®½āĘ½ŗā³£Źż”£
£Ø1£©øł¾ŻN2”¢O2·Ö×ÓÖŠ»Æѧ¼üµÄ¼üÄÜ·Ö±šŹĒ946kJmol-1”¢497kJmol-1ŅŌ¼°·“Ó¦N2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180kJmol-1æÉÉčNO·Ö×ÓÖŠ»Æѧ¼üµÄ¼üÄÜĪŖX£¬ŌņÓŠ£ŗ946kJmol-1+497kJmol-1-2X=180kJmol-1µĆ£ŗX=631.5kJmol-1£¬¹Ź“š°øĪŖ£ŗ631.5£»
£Ø2£©25”ꏱ£¬pHµČÓŚ5µÄCH3COOHČÜŅŗÖŠc£ØH+£©=1.0”Į10-5mol/L£¬Kw=c£ØOH-£©”Įc£ØH+£©=10-14£¬ČÜŅŗÖŠµÄc£ØOH-£©= Kw / c£ØH+£©=1.0”Į10-9mol/L£¬pHµČÓŚ5µÄCH3COOHČÜŅŗÖŠĒāĄė×ÓĄ“Ō“ĪŖŅŅĖįµÄµēĄėŗĶĖ®µÄµēĄė£¬µ«ŅŅĖįČÜŅŗÖŠĖ®µēĄė³öµÄĒāĄė×ÓÅØ¶ČµČÓŚĒāŃõøłĄė×ÓÅØ¶Č£¬ĖłŅŌÓÉĖ®µēĄė³öµÄC£ØH+£©ŹĒ1.0”Į10-9mol/L£»ĶłČÜŅŗÖŠ¼ÓČėÉŁĮæNaOH¹ĢĢ壬·“Ӧɜ³É“×ĖįÄĘ£¬ČÜŅŗÖŠc(CH3COOH)/ c(CH3COO-) c(H+)=1/Ka£¬ĪĀ¶Č²»±äµēĄėĘ½ŗā³£Źż²»±ä£¬ČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£¬Ąė×ÓÅØ¶Č¹ŲĻµĪŖ£ŗc£ØCH3COO-£©+c£ØOH-£©=c£ØNa+£©+c£ØH+£©£¬¹Ź“š°øĪŖ£ŗ1.0”Į10-9£»²»±ä£»c£ØCH3COO-£©+c£ØOH-£©=c£ØNa+£©+c£ØH+£©£»
£Ø3£©³£ĪĀĻĀŌŚ20mL0.1mol/L Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1mol/L HClČÜŅŗ40mL£¬ĻČ·“Ӧɜ³ÉĢ¼ĖįĒāÄĘ£¬ŌŁÓėŃĪĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼”¢Ė®”£
¢ŁÓÉ·“Ó¦¼°Ķ¼ĻóæÉÖŖ£¬ŌŚĶ¬Ņ»ČÜŅŗÖŠ£¬H2CO3”¢HCO3-”¢CO32-²»ÄÜ“óĮæ¹²“ę£¬¹Ź“š°øĪŖ£ŗ²»ÄÜ£»
¢ŚÓÉĶ¼ĻóæÉÖŖ£¬pH=7Ź±£¬c£ØOH-£©=c£ØH+£©£¬ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄÖ÷ŅŖĪ¢Į£ĪŖHCO3-£»ÓɵēŗÉŹŲŗćæÉÖŖc£ØNa+£©+c£ØH+£©=c£ØCl-£©+c£ØHCO3-£©+c£ØOH-£©£¬Ōņc£ØNa+£©>c£ØCl-£©£¬ŅņHCO3-Ė®½ā£¬Ōņc£ØNa+£©>c£ØCl-£©>c£ØHCO3-£©>c£ØOH-£©=c£ØH+£©£¬¹Ź“š°øĪŖ£ŗHCO3-£»c£ØNa+£©>c£ØCl-£©>c£ØHCO3-£©>c£ØOH-£©=c£ØH+£©£»
¢ŪCO32-µÄĖ®½ā³£ŹżKh= c£ØHCO3-£©c£ØOH-£©/ c£ØCO32-£©£¬µ±ČÜŅŗÖŠc£ØHCO3-£©£ŗc£ØCO32-£©=1£ŗ1Ź±£¬Ķ¼ĻóæÉÖŖPH=10£¬ČÜŅŗÖŠc£ØH+£©=10-10mol/L£¬ÓÉKwæÉÖŖc£ØOH-£©=10-4mol/L£¬ŌņKh= c£ØOH-£©=10-4mol/L£¬¹Ź“š°øĪŖ£ŗ10-4”£


 ĶõŗóŠŪѧ°ø½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
ĶõŗóŠŪѧ°ø½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø ŗ£µķæĪŹ±ŠĀ×÷Ņµ½š°ń¾ķĻµĮŠ“š°ø
ŗ£µķæĪŹ±ŠĀ×÷Ņµ½š°ń¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×éĪļÖŹ»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄŹĒ
A.ŃõĘųŗĶ³ōŃõB.ŅŅĖįÓė¼×Ėį¼×õ„C.16O ŗĶ 18OD.ŅŅ“¼ŗĶ¼×“¼
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČżøöČŻ»ż¾łĪŖ 1.0 L µÄŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗCH3OH(g)+CO(g) CH3COOH(g) ¦¤H<0”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
ČŻĘ÷±ąŗÅ | ĪĀ¶Č/K | ĪļÖŹµÄĘšŹ¼ÅضČ/mol/L | ĪļÖŹµÄĘ½ŗāÅضČ/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. “ļĘ½ŗāŹ±£¬ČŻĘ÷ I ÓėČŻĘ÷ II ÖŠµÄ×ÜŃ¹ĒæÖ®±ČĪŖ 3 : 4
B. “ļĘ½ŗāŹ±£¬ČŻĘ÷ II ÖŠ ![]() ±ČČŻĘ÷ I ÖŠµÄŠ”
±ČČŻĘ÷ I ÖŠµÄŠ”
C. “ļĘ½ŗāŹ±£¬ČŻĘ÷¢óÖŠµÄÕż·“Ó¦ĖŁĀŹ±ČČŻĘ÷ I ÖŠµÄ“ó
D. “ļĘ½ŗāŹ±£¬ČŻĘ÷ I ÖŠCH3OH ×Ŗ»ÆĀŹÓėČŻĘ÷ III ÖŠ CH3COOH ×Ŗ»ÆĀŹÖ®ŗĶŠ”ÓŚ 1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ĘĶæó(CuFeS2)ŹĒÖŲŅŖµÄæó²Ų£¬ŅŌ»ĘĶæóĪŖŌĮĻÉś²ś¼īŹ½ĀČ»ÆĶŗĶĢśŗģ(Ńõ»ÆĢś)ŃÕĮĻµÄ¹¤ŅÕĮ÷³ĢČēĶ¼ĖłŹ¾”£

£Ø1£©·“Ó¦¢ńµÄĄė×Ó·½³ĢŹ½ĪŖ_____________£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮŹĒ________________”£
£Ø2£©·“Ó¦¢ņµÄĄė×Ó·½³ĢŹ½ĪŖ_________________________”£
£Ø3£©·“Ó¦¢öŹĒŌŚ45~50”ęµÄĢõ¼žĻĀ½ųŠŠµÄ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ__________________”£
£Ø4£©¼īŹ½ĀČ»ÆĶÓŠ¶ąÖÖ×é³É£¬æɱķŹ¾ĪŖCua(OH)bClc”¤xH2O£¬ĪŖ²ā¶Øij¼īŹ½ĀČ»ÆĶµÄ×é³É£¬Ä³ŹµŃ銔×é½ųŠŠĻĀĮŠŹµŃé£ŗ
¢Ł³ĘȔѳʷ9.30g£¬ÓĆÉŁĮæĻ”HNO3ČܽāŗóÅä³É100.00mLČÜŅŗA£»
¢ŚČ”25.00mLČÜŅŗA£¬¼ÓČė×ćĮæAgNO3ČÜŅŗ£¬µĆµ½AgCl¹ĢĢå1.435g£»
¢ŪĮķČ”25.00mLČÜŅŗA£¬µ÷½ŚpHĪŖ4~5£¬ÓĆÅضČĪŖ0.40mol”¤L-1µÄEDTA(Na2H2Y”¤2H2O)±ź×¼ČÜŅŗµĪ¶ØCu2+(Ąė×Ó·½³ĢŹ½ĪŖCu2++H2Y2-=CuY2-+2H+)£¬µĪ¶ØÖĮÖÕµć£¬Ļūŗıź×¼ČÜŅŗ50.00mL”£Ķعż¼ĘĖćČ·¶ØøĆѳʷµÄ»ÆѧŹ½ĪŖ___________(Ģī»ÆѧŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗpOH=©lgc(OH©)£¬298KŹ±£¬Ļņ20.00mL0.10molL©1°±Ė®ÖŠµĪČė0.10molL©1µÄŃĪĖį£¬ČÜŅŗµÄpHŗĶpOHÓė¼ÓČėŃĪĖįĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
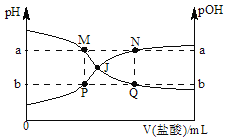
A. M”¢PĮ½µćµÄŹżÖµÖ®ŗĶa+b=14
B. MµćĖ®µÄµēĄė³Ģ¶Č±ČQµć“ó
C. ĒśĻßPJN±ķŹ¾ČÜŅŗÖŠpHµÄ±ä»Æ
D. pHÓėpOH½»²ęµćJ¶ŌÓ¦µÄV(ŃĪĖį)=20.00 mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŅŗ°±µÄŠŌÖŹÓėĖ®ĻąĖĘ”£T”ꏱ£¬NH3+NH3![]() NH4++NH2-£¬NH4+µÄĘ½ŗāÅضČĪŖ1”Į10-15mol/L£¬ŌņĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
NH4++NH2-£¬NH4+µÄĘ½ŗāÅضČĪŖ1”Į10-15mol/L£¬ŌņĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ( )
A. ŌŚ“ĖĪĀ¶ČĻĀŅŗ°±µÄĄė×Ó»żĪŖ1”Į10-17
B. ŌŚŅŗ°±ÖŠ·ÅČė½šŹōÄĘ£¬æÉÉś³ÉNaNH2
C. ŗćĪĀĻĀ£¬ŌŚŅŗ°±ÖŠ¼ÓČėNH4Cl£¬æÉŹ¹Ņŗ°±µÄĄė×Ó»ż¼õŠ”
D. ½µĪĀ£¬æÉŹ¹Ņŗ°±µēĄėĘ½ŗāÄęĻņŅĘ¶Æ£¬ĒŅc(NH4+)<c(NH2-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼øÖÖĪļÖŹµÄĻĀĮŠÓ¦ÓĆĢåĻÖĘ仹ŌŠŌµÄŹĒ
A.Ģś·Ū×÷Ź³Ę·“üÄŚµÄĶŃŃõ¼ĮB.ĒāŃõ»ÆĀĮ×÷ĪøĖįÖŠŗĶ¼Į
C.Ė®²£Į§ÓĆ×÷ľ²Ä·Ą»š¼ĮD.ClO2ÓĆÓŚ×ŌĄ“Ė®Ļū¶¾
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§Éč¼ĘĮĖ²ā¶ØĘųĢåĦ¶ūĢå»żµÄĢ½¾æŹµŃ飬ĄūÓĆĀČĖį¼Ų·Ö½āÖĘO2”£

ŹµŃé²½ÖčČēĻĀ£ŗ
¢ŁĮ¬½ÓŗĆŹµŃé×°ÖĆ£¬¼ģ²é×°ÖƵÄĘųĆÜŠŌ”£
¢Ś°ŃŹŹĮæµÄĀČĖį¼Ų·ŪÄ©ŗĶÉŁĮ涞Ńõ»ÆĆĢ·ŪÄ©»ģŗĻ¾łŌČ£¬·ÅČėøÉŌļµÄŹŌ¹ÜÖŠ£¬×¼Č·³ĘĮæŹŌ¹ÜŗĶŅ©Ę·µÄ×ÜÖŹĮæĪŖ15.95 g”£
¢Ū¼ÓČČ£¬æŖŹ¼·“Ó¦£¬Ö±µ½²»ŌŁÓŠĘųĢå²śÉśĪŖÖ¹”£
¢Ü²āĮæÅÅČėĮæĶ²ÖŠĖ®µÄĢå»żĪŖ285.0 mL£¬»»Ėć³É±ź×¼×“æöĻĀŃõĘųµÄĢå»żĪŖ279. 7 mL”£
¢Ż×¼Č·³ĘĮæŹŌ¹ÜŗĶ²ŠĮōĪļµÄÖŹĮæĪŖ15. 55 g”£
øł¾ŻÉĻŹöŹµŃé¹ż³Ģ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ČēŗĪ¼ģ²é×°ÖƵÄĘųĆÜŠŌ£æ____________________________________________”£
(2)ŅŌĻĀŹĒ²āĮæŹÕ¼ÆµÄĘųĢåĢå»ż±ŲŠė°üĄØµÄ¼øøö²½Öč£ŗ
¢Łµ÷ÕūĮæĶ²µÄø߶ȏ¹¹ćæŚĘæŗĶĮæĶ²ÄŚµÄŅŗĆęø߶ČĻąĶ¬£»
¢ŚŹ¹ŹŌ¹ÜŗĶ¹ćæŚĘæÄŚĘųĢ嶼ĄäČ“ÖĮŹŅĪĀ£»
¢Ū¶ĮČ”ĮæĶ²ÄŚŅŗĢåµÄĢå»ż”£
ÕāČż²½²Ł×÷µÄÕżČ·Ė³ŠņŹĒ_________________(ĒėĢīŠ“²½Öč“śŗÅ)”£
½ųŠŠ¢ŪµÄŹµŃé²Ł×÷Ź±£¬ČōŃöŹÓ¶ĮŹż£¬Ōņ¶ĮČ”ŃõĘųµÄĢå»ż_______(Ģī”°Ę«“ó”±”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±)”£
(3)ŹµŃé¹ż³ĢÖŠ²śÉśŃõĘųµÄĪļÖŹµÄĮæŹĒ_____mol£»ŹµŃé²āµĆŃõĘųµÄĘųĢåĦ¶ūĢå»żŹĒ______(±£ĮōŠ”ŹżµćŗóĮ½Ī»)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æBHTŹĒŅ»ÖÖ³£ÓƵď³Ę·æ¹Ńõ»Æ¼Į£¬“Ó![]() ³ö·¢ŗĻ³ÉBHTµÄ·½·ØÓŠČēĻĀĮ½ÖÖ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
³ö·¢ŗĻ³ÉBHTµÄ·½·ØÓŠČēĻĀĮ½ÖÖ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A. BHTŌŚĖ®ÖŠµÄČܽā¶ČŠ”ÓŚ±½·Ó
B. BHT”¢![]() ”¢±½·Ó»„ĪŖĶ¬ĻµĪļ
”¢±½·Ó»„ĪŖĶ¬ĻµĪļ
C. Čō·½·ØŅ»ŹōÓŚ¼Ó³É·“Ó¦£¬ŌņĪļÖŹAæÉÄÜĪŖ£ØCH3)2C=CH2
D. ĻąĶ¬Ģõ¼žĻĀ£¬ ![]() Óė½šŹōÄĘ·“Ó¦±Č£ØCH3)3COHÓė½šŹōÄĘ·“Ó¦µÄĖŁĀŹŠ”
Óė½šŹōÄĘ·“Ó¦±Č£ØCH3)3COHÓė½šŹōÄĘ·“Ó¦µÄĖŁĀŹŠ”
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com