
·ÖĪö £Ø1£©ŅŃÖŖ£ŗ¢ŁN2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180.6kJ•mol-1
¢ŚC £Øs£©+O2£Øg£©=CO2£Øg£©”÷H=-393.5kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢Ś-¢ŁæɵĆC£Øs£©+2NO£Øg£©=CO2£Øg£©+N2£Øg£©£¬¾Ż“Ė¼ĘĖć£»
£Ø2£©øł¾ŻČż¶ĪŹ½£ŗ
SO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©
ĘšŹ¼£Ømol£©£ŗn n 0
×Ŗ»Æ£Ømol£©£ŗx x x
Ę½ŗā£Ømol£©£ŗn-x n-x x
øł¾ŻĶ¬ĪĀĶ¬Ń¹ĻĀ£¬ĘųĢåµÄĢå»żÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±ČæÉÖŖ£¬$\frac{2n}{2n-x}$=$\frac{10}{8}$£¬½āµĆ£ŗx=0.4n mol£»
¢Łøł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖć£»
¢Śøł¾Ż»ÆŃ§Ę½ŗā³£ŹżøÅÄī¼ĘĖć£»
¢ŪŗćĪĀŗćŃ¹Ģõ¼žĻĀ£¬½«0.5n mol SO2Óė 0.5n mol Cl2³äČėøĆČŻĘ÷£¬ÓėŌĘ½ŗā±ČÖµĻąĶ¬£¬Ōņµ½“ļĘ½ŗāדĢ¬Ź±ÓėŌĘ½ŗāµČŠ§£¬µ½“ļĘ½ŗāדĢ¬Ź±£¬»ģŗĻĪļÖŠSO2Cl2µÄĪļÖŹµÄĮæŹĒ0.2n mol£»
£Ø3£©ÓÉĶ¼æÉÖŖSO2Óė°±Ė®»ģŗĻ·¢Éś·“Ó¦²śÉśNH4HSO3£¬ĻņøĆČÜŅŗÖŠĶØČėNO2ĘųĢ壬ÓėNH4HSO3µēĄė²śÉśµÄHSO3-·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ŌŁøł¾ŻŹŲŗ抓·½³Ģ£»
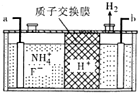
£Ø4£©¢ŁÓÉĶ¼æÉÖŖ£¬b¼«ÉĻHSO3-µĆµē×Ó·¢Éś»¹Ō·“Ӧɜ³ÉS2O42-£¬Ōņaµē¼«ĪŖÕż¼«£¬bµē¼«ĪŖøŗ¼«£¬½įŗĻµē½āÖŹČÜŅŗŹéŠ“£»
¢ŚĄė×Ó·½³ĢŹ½ĪŖ£ŗ4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ£ŗ¢ŁN2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180.6kJ•mol-1
¢ŚC £Øs£©+O2£Øg£©=CO2£Øg£©”÷H=-393.5kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£ŗ¢Ś-¢ŁæɵĆC£Øs£©+2NO£Øg£©=CO2£Øg£©+N2£Øg£©£¬”÷H=-574.1kJ•mol-1£»
¹Ź“š°øĪŖ£ŗ-574.1£»
£Ø2£©øł¾ŻČż¶ĪŹ½£ŗ
SO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©
ĘšŹ¼£Ømol£©£ŗn n 0
×Ŗ»Æ£Ømol£©£ŗx x x
Ę½ŗā£Ømol£©£ŗn-x n-x x
øł¾ŻĶ¬ĪĀĶ¬Ń¹ĻĀ£¬ĘųĢåµÄĢå»żÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±ČæÉÖŖ£¬$\frac{2n}{2n-x}=\frac{10}{8}$£¬½āµĆ£ŗx=0.4n mol£¬
¢Łv£ØSO2£©=$\frac{0.4nmol}{tmin}$=$\frac{0.4n}{t}$mol/min£»
¹Ź“š°øĪŖ£ŗ$\frac{0.4n}{t}$£»
¢ŚĘ½ŗā³£ŹżµČÓŚÉś³ÉĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż³żŅŌ·“Ó¦ĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż£¬¹Ź“ĖĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{£Ø0.4n”Ā8£©}{£Ø0.6n”Ā8£©^{2}}$=$\frac{80}{9n}$£»
¹Ź“š°øĪŖ£ŗ$\frac{80}{9n}$£»
¢ŪÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬½«n mol SO2Óėn mol Cl2³äČėČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ£¬µĆµ½SO2Cl2 0.4n mol£¬ŗćĪĀŗćŃ¹Ģõ¼žĻĀ£¬½«0.5n mol SO2Óė 0.5n mol Cl2³äČėøĆČŻĘ÷£¬ÓėŌĘ½ŗā±ČÖµĻąĶ¬£¬Ōņµ½“ļĘ½ŗāדĢ¬Ź±ÓėŌĘ½ŗāµČŠ§£¬¹Ź½«0.5n mol SO2Óė 0.5n mol Cl2³äČėøĆČŻĘ÷£¬µ½“ļĘ½ŗāדĢ¬Ź±£¬»ģŗĻĪļÖŠSO2Cl2µÄĪļÖŹµÄĮæŹĒ0.2n mol£»
¹Ź“š°øĪŖ£ŗ0.2n mol£»
£Ø3£©SO2Óė°±Ė®»ģŗĻ·¢Éś·“Ó¦²śÉśNH4HSO3£¬ĻņøĆČÜŅŗÖŠĶØČėNO2ĘųĢ壬ÓėNH4HSO3µēĄė²śÉśµÄHSO3-·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬øł¾Żµē×ÓŹŲŗć”¢µēŗÉŹŲŗć”¢Ō×ÓŹŲŗć£¬æɵƷ“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ2NO2+4HSO3-=N2+4SO42-+4H+£»
¹Ź“š°øĪŖ£ŗ2NO2+4HSO3-=N2+4SO42-+4H+£»
£Ø4£©¢ŁÓÉĶ¼æÉÖŖ£¬b¼«ÉĻHSO3-µĆµē×Ó·¢Éś»¹Ō·“Ӧɜ³ÉS2O42-£¬Ōņaµē¼«ĪŖÕż¼«£¬bµē¼«ĪŖøŗ¼«£¬Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ2HSO3-+2H++2e-=S2O42-+2H2O£»
¹Ź“š°øĪŖ£ŗ2HSO3-+2H++2e-=S2O42-+2H2O£»
¢ŚŅõ¼«ÅųöµÄČÜŅŗÖŠŗ¬ÓŠS2O42-£¬ŌŚ¼īŠŌĢõ¼žĻĀ£¬Ź¹NO2×Ŗ»ÆĪŖĪŽŗ¦ĘųĢåN2£¬Ķ¬Ź±×ŌÉķ±»Ńõ»ÆĪŖSO32-£¬ŌņøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O£»
¹Ź“š°øĪŖ£ŗ4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖøĒĖ¹¶ØĀÉ”¢»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖćŗĶµē»ÆѧµÄĻą¹ŲŌĄķ£¬×ŪŗĻŠŌ½ĻĒæ£¬Ń§ÉśŅŖ×¢ŅāÕĘĪÕ»ł“”£¬Įé»ī½āĢā£¬ÉóĒåĢāÄæĖłøųŠÅĻ¢£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c£ØH2S£©/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c£ØSO2£©/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 µŖ”¢Į×¼°Ęä»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠÓŠÖŲŅŖµÄÓĆĶ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ
µŖ”¢Į×¼°Ęä»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠÓŠÖŲŅŖµÄÓĆĶ¾£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| |ĪĀ¶Č/”ę | 700 | 900 | 830 | 1000 | 1200 |
| Ę½ŗā³£Źż | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ū¢Ü | B£® | ¢Ū | C£® | ¢Ł¢Ū | D£® | ¢Ś¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | AlCl3ØTAl3++Cl- | B£® | Ca£ØOH£©2ØTCa2++£ØOH£©2- | ||
| C£® | Mg£ØNO3£©2ØTMg2++2NO3- | D£® | Na2SO4ØTNa2++SO42- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com