
| ���� |
| ���¡���ѹ |
| ���� |
| ���¡���ѹ |
| ���� |
| ���¡���ѹ |
| 582.4L |
| 22.4L?mol-1 |
| 4 |
| 4+9 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
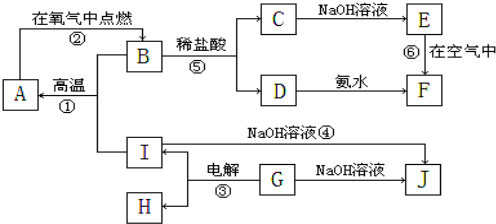
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
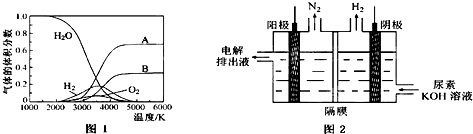
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
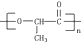 ��һ�ֵ������۶��ɵģ��õ���Ľṹ��ʽΪ
��һ�ֵ������۶��ɵģ��õ���Ľṹ��ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| ͭƽ���ܽ����� ����10-3mol?L-1?min-1�� | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| T/K | 673 | 773 | �� |
| K | K1 | K2 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
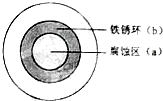 ��NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�ԲȦ��������a���ѱ���ʴ���䰵����Һ�������γ���ɫ�����b������ͼ��ʾ�������������Ҫԭ����Һ��֮�����������ȱ�Ե���٣�����˵����ȷ���ǣ�������
��NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�ԲȦ��������a���ѱ���ʴ���䰵����Һ�������γ���ɫ�����b������ͼ��ʾ�������������Ҫԭ����Һ��֮�����������ȱ�Ե���٣�����˵����ȷ���ǣ�������| A��Һ���е�Cl - ��a����b��Ǩ�� |
| B������ʴ���ص���������Ҳ���� |
| C��Һ���µ�Fe������ԭ��Ӧ������ʴ�����ɵ�Fe2+��a����b��Ǩ�ƣ���b����OH- �γ�Fe��OH��2����һ����������ˮ�γ����� |
| D��Һ�α�Ե���������������ĵ缫��ӦΪ��O2+2H2O+4e-=4OH- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com