
【题目】锌空气电池的电容量大,可作为汽车的清洁能源。总反应式为:2Zn+O2+2H2O=2Zn(OH)2。示意图如图所示:
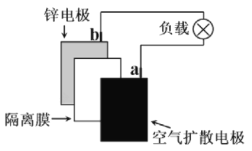
有关该电池的说法正确的是( )
A.电池可以用稀硫酸做电解质溶液
B.电池工作时,电子由a电极沿导线流向b电极
C.空气扩散电极上的电极反应:O2+2H2O+4e-=4OH-
D.阻隔空气进入锌--空气电池,电池停止工作
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
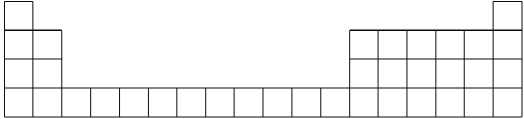
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 标准状况下,22.4L水中所含的分子数约为6.02×1023
B. 标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C. 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数不同
D. 2.24L CO2中含有的原子数为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
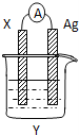
(1)电极X的材料是_______;电解质溶液Y是________;
(2)银电极上发生的电极反应式为___________________;
(3)外电路中的电子是从______→______;
(4)当有1.6 g铜溶解时,银棒增重______g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
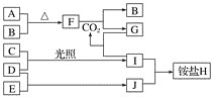
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学土肥外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液,现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,回答下列问题:
[Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数]
(1)CH3COOH的电离方程式为__。
(2)该缓冲溶液中离子浓度由大到小的顺序是___。
(3)25℃时,Ka(CH3COOH)___Kb(CH3COO-)(填“>”“<”或“=”)。
(4)用1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)__mol/L。
(5)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是__(填写选项字母)。
a.代谢产生的![]() 被HCO3-结合形成H2CO3
被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H+中和,H+又由H2CO3电离补充
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
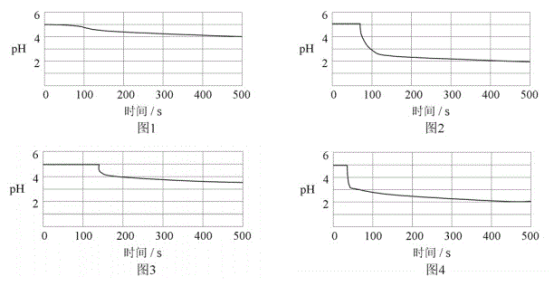
根据以上数据,可得到的结论是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5,下列说法正确的是
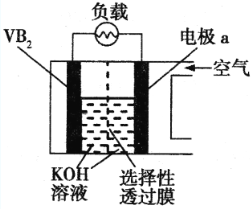
A.电极a为电池负极,发生还原反应
B.每消耗1molVB2转移6mol电子
C.电池工作时,OH向电极a移动
D.VB2极发生的电极反应为:2VB2+22OH-22e=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图,有关M的下列叙述中正确的是

A. 可与H2反应,1 molM最多消耗1 molH2
B. 可与浓溴水反应,1molM最多消耗4 molBr2
C. 可与NaOH溶液反应,1 mol M最多消耗3 molNaOH
D. 常温下,M在水中的溶解度小于苯酚在水中的溶解度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com