
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)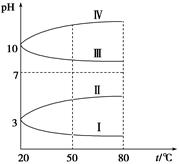
如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.(2分)
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.(2分)
(2)小于
(3)①ⅠNH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小 ②10-3mol·L-1
(4)a (Na+)>c(SO42-)>c(NH4+>c(OH-)=c(H+)
解析试题分析:(1)由于 NH4Al(SO4)2溶于水电离出的Al3+水解生成的Al(OH)3晶体具有吸附性,即Al3++3H2O Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水。
Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水。
(2)由于NH4HSO4溶于水完全电离出氢离子,抑制NH4+水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)①由于 NH4Al(SO4)2溶于水电离出的NH4+、Al3+水解溶液显酸性,且水解是吸热的,加入促进水解,溶液的酸性增强,pH减小,因此符合条件的曲线是I。
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中pH=3,根据电荷守恒可知,20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)+c(OH-) =c(NH4+)+c(H+)+3c(Al3+),则 2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-) =10-3-10-11mol·L-1。
(4)向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液反应的离子方程式因此为H++OH-=H2O、OH-+NH4+=NH3·H2O。d点恰好中和氢离子,溶液中的NH4+水解促进水的电离。D点之后NH4+浓度减小,所以溶液中水的电离程度最大是a点;在b点,pH=7,溶液显中性,溶液中的溶质是硫酸钠和硫酸铵和氨气,则溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
考点:考查胶体性质、水的电离、盐类水解、溶液中离子浓度大小比较。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:单选题
下列物质按照纯净物、化合物、强电解质、弱电解质和非电解质顺序排列的是
| A.纯盐酸、水煤气、硫酸、醋酸、干冰 |
| B.聚氯乙烯、漂白粉、苛性钠、氢硫酸、三氧化硫 |
| C.冰醋酸、福尔马林、硫酸钡、氢氟酸、氯气 |
| D.冰水混合物、胆矾、氯化钾、次氯酸、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
(1)A、B、C三种物质可以归为一类的依据是 。
(2)将C归为化合物,将D归为单质的理由是 。
(3)用化学反应方程式表示为 。
化学变化过程中消耗的A物质和生成的C物质的质量比为 。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 (填物质的化学式)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时) 、 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是 。
| A.Au | B.Cu | C.Al | D.Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生活和生产中常用到胶体的性质,请看下述四例:
(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是
_______________________________________________。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是________。
(3)水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了________原理。
(4)四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁酸盐(FeO42—),FeO42—有强氧化性,可以杀菌消毒。高铁酸盐还有净化水的作用,能净化水的原因是 ______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Fe(OH)3胶体在生活中有重要应用,利用FeCl3和沸水反应制备的Fe(OH)3胶体中常混有FeCl3和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
(1)实验室制取Fe(OH)3胶体的方法是________,用________方法除去胶体中的浑浊物;根据________现象证明胶体已经制成。
(2)检验溶液中存在Fe3+和H+的方法是__________________________________________
(3)除去胶体中混有的FeCl3和HCl的方法是:_________________________________。
(4)如何用实验的方法证明胶体和Cl-已经分离?___________________________。
(5)鉴别Fe(OH)3胶体和FeCl3溶液最简单的方法是_________________________________。
(6)高铁酸钠(Na2FeO4)的氧化性比KMnO4更强,它是一种备受关注的新型净水剂,请指出Na2FeO4净水的原理,并说明该净水剂有何优越性_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol?L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=?1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=?1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式或化学方程式书写正确的是 ( )
A.实验室用氯化铵与消石灰制氨气 NH4++OH- NH3↑+H2O NH3↑+H2O |
| B.将CO2通入BaCl2溶液中 H2O +CO2+Ba2+ =BaCO3↓+2H+ |
| C.少量SO2通入加漂白粉的水溶液中 SO2+H2O+Ca2++3ClO- = CaSO4↓+2HClO+Cl- |
D.用H2还原MgO H2+MgO  Mg+H2O Mg+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱; 同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
| A.只有②④ | B.只有②③⑤ | C.只有①②④ | D.只有②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com