
以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4________+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是__________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)___________。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是___________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。计算:该铵盐中氮元素的质量分数是___________%;若铵盐质量为15.00 g,浓硫酸增加的质量为___________。(计算结果保留两位小数)
【答案】
(1)FeS2
(2)2SO2+O2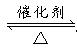 2SO3
2SO3
(3) a b d
(4)SO3(g)+H2O(l)====H2SO4(l);ΔH=-130.3 kJ/mol
(5)①SO2+Br2+2H2O====4H++2Br-+
②14.56 2.31 g
【解析】本题具体考查“硫酸工业”及“三废”处理。涉及化工原理、工艺流程、热化学方程式的书写、离子方程式的书写及计算。
(2)接触室中反应是将SO2催化氧化为SO3。书写关键:“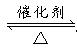 ”。
”。
(3)矿石粉碎,增加与O2接触面积,便于充分反应,化工生产中常采用提高一种原料(通常较为廉价、易得)的浓度,来提高另一种原料的转化率。催化剂只能提高速率,不能使平衡发生移动,与转化率无关。沸腾炉中炉渣成分主要是Fe2O3,可回收处理炼Fe。
(4)热化学方程式书写易错点:①漏标状态,②ΔH的正负,③系数与ΔH数值不一致,④ΔH单位误写成kJ。
⑤SO2+Br2+H2O====H2SO4+2HBr,生成两种强酸。


科目:高中化学 来源: 题型:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
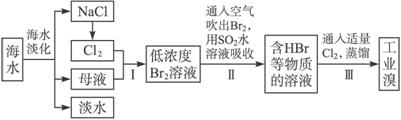
(1)请列举海水淡化的两种方法:__________________、__________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、_________、_________或H2、_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为__________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:______________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_______________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_______________。
④C中液体产物颜色为_______________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1 m3烟气中最高允许含NO___________________L(标准状况,保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,则碳酸钠溶液物质的量浓度为__________________________mol·L-1(保留2位小数)。
(3)已知:NO+NO2+Na2CO3 2NaNO2+CO2①
2NaNO2+CO2①
2NO2+Na2CO3 NaNO2+NaNO3+CO2②
NaNO2+NaNO3+CO2②
1 m3含2 000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______________排放标准(填“符合”或“不符合”),理由:_________________。
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3 3NO2+H2O
3NO2+H2O
当烟气中n(NO)∶n(NO2)=2∶3时,吸收率最高。
1 m3烟气含2 000 mg NOx,其中n(NO)∶n(NO2)=9∶1。
计算:(ⅰ)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)。
(ⅱ)1 m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
《化学与技术》模块(选考题)
普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F
B.Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4
D.CaHPO4和Ca(H2PO4)2
查看答案和解析>>
科目:高中化学 来源: 题型:
在石灰窑中烧制生石灰,1 mol CaCO3完全分解所需要的能量,可燃烧0.453 mol碳来提供。设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是( )
A.0.43 B.0.46 C.0.49 D..0.52
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com