
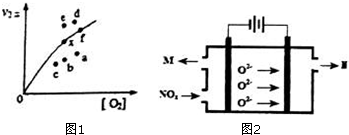
 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知分析 (1)①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})c({O}_{2})}$,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,而正反应是放热反应,所以升高温度,平衡常数减小,由此分析解答;
(2)因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,由此分析解答;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-);
(4)O2-在阳极发生氧化反应,而氮的氧化物在阴极发生还原反应,由此分析解答;
(5)根据沉淀溶解平衡常数Ksp进行计算.
解答 解:(1))①2NO(g)?N2O2(g);②N2O2(g)+O2(g)?2NO2(g),而目标反应2NO(g)+O2(g)?2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{2})c({O}_{2})}$=$\frac{{K}_{1正}{K}_{2正}}{{K}_{1逆}{K}_{2逆}}$,而正反应是放热反应,所以升高温度,平衡常数减小,
故答案为:△H1+△H2;$\frac{{K}_{1正}{K}_{2正}}{{K}_{1逆}{K}_{2逆}}$;减小;
(2)因为决定2NO(g)+O2(g)?2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性,c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),
故答案为:酸;<;
(4)O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-;O2;
(5)当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10-5,此时银离子浓度=$\sqrt{\frac{4.0×1{0}^{-5}}{1.0×1{0}^{-5}}}$=2.0,
c(NO2-)=$\frac{9.0×1{0}^{-4}}{2.0}$=4.5×10-4 mol•L-1,故答案为:4.5×10-4 mol•L-1.
点评 本题涉及盖斯定律的应用、化学平衡的有关计算,电极反应式的书写知识,注意知识的综合应用是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 浓度相同的Na2CO3和NaHCO3混合溶液中,c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1mol/L①醋酸②氯化铵③硫酸溶液中,水电离产生的氢离子浓度大小顺序是②>①>③ | |
| C. | 0.1mol/L的NaHCO3溶液中 C(Na+)+c(H+)=c(OH-)+c(HCO3-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
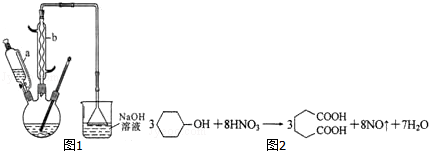
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 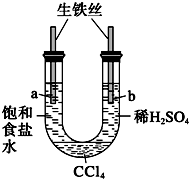 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 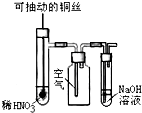 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 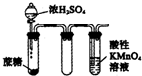 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
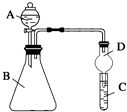 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
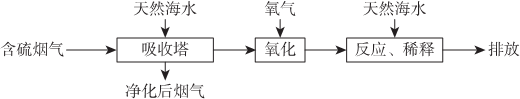
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com