
(1)实验室提供CuO、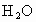 、NaOH溶液和稀
、NaOH溶液和稀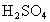 四种物质,请写出制备
四种物质,请写出制备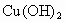 时有关反应的化学方程式为_______________________.
时有关反应的化学方程式为_______________________.
(2)写出既能跟硫酸铜溶液又能跟稀硫酸反应的三种不同类别物质的化学式_________.
科目:高中化学 来源: 题型:阅读理解
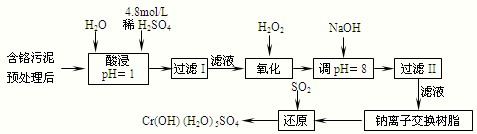
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验现象的解释及结论 |
| ①各取少量样品于A、B、C、D 4支试管中,加入足量NaOH浓溶液,加热. | 4支试管中均产生能使湿润的红色石蕊试纸变蓝的气体. | 4支试管中的样品都含有 NH4+ NH4+ 离子. |
| ②向4支试管中分别滴加BaCl2溶液. | 试管A、B中产生白色沉淀,C、D中无明显现象. | 产生白色沉淀的离子方程式是 Ba2++CO32-=BaCO3↓ Ba2++CO32-=BaCO3↓ ,Ba2++SO42-=BaSO4↓ Ba2++SO42-=BaSO4↓ . |
| ③继续向试管A、B中分别加入足量盐酸. | 试管A中沉淀溶解且产生无色气体;B中无明显变化. | 试管A中原样品为 (NH4)2CO3 (NH4)2CO3 ,试管B中原样品为 (NH4)2SO4 (NH4)2SO4 . |
| ④继续向试管C、D中分别加入足量硝酸酸化,再分别滴加AgNO3溶液. | 试管C、D中均有白色沉淀产生. | 无法鉴别试管C、D中的样品. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 | 写出下列离子方程式 |
| 探究Fe2+具有还原性 | 取少量0.1mol?L-1FeCl溶液,加入少量KSCN溶液后,再往溶液中加入少量 新制氯水 新制氯水 |
溶液先不变红,后变为血红色 | ①Fe2+发生的反应: 2Fe2++Cl2=2Fe3++2Cl- 2Fe2++Cl2=2Fe3++2Cl- |
| 探究Fe3+具有氧化性 | 取少量0.1mol?L-1FeCl溶液,加入足量 铁粉 铁粉 后,再往溶液中加入少量KSCN溶液 |
溶液不变为血红色 | Fe3+发生的反应: 2Fe3++Fe=3Fe2+ 2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com