【答案】
分析:B的单质分子中有三对共用电子,可知B为N,单质分子为氮气分子,C原子电子数比E原子电子数少5个,且C、D、E原子序数依次增大,原子半径按C、E、D顺序依次增大,所以C是氧,E是铝,C、D、E三种元素原子的最外层电子数之和为10,所以D是Na,则A是H.
(1)双氧水是含有共价键的共价化合物,根据电子式的书写方法来回答;
(2)氢氧化钠时离子化合物,根据原电池和电解池的工作原理知识来书写电极反应;
(3)①根据压强对化学平衡移动的影响知识来判断;
②根据等效平衡原理确定可逆的化学反应的焓变,进而来书写热化学方程式;
③根据压强对化学平衡移动的影响和等效平衡原理来回答;
(4)①据水的离子积常数表达式Kw=C(H
+)?c(OH
-)来计算酸溶液中水电离出的氢离子浓度;
②硝酸铵中,铵根离子水解导致溶液显示酸性,根据离子浓度大小比较知识来判断;
(5)过氧化钠具有氧化性,根据题意可知氧化含CN
-的工业废水,将得到一种能够参与大气生态环境循环的气体氮气以及C0
2等物质,据此来书写化学方程式.
解答:解:B的单质分子中有三对共用电子,可知B为N,单质分子为氮气分子,C原子电子数比E原子电子数少5个,且C、D、E原子序数依次增大,原子半径按C、E、D顺序依次增大,所以C是氧,E是铝,C、D、E三种元素原子的最外层电子数之和为10,所以D是Na,则A是H,
(1)H和O两元素形成的原子个数比为1:1且呈电中性的微粒为双氧水,是含有共价键的共价化合物,它的电子式为
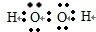
,故答案为:
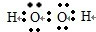
;
(2)A、C、D可形成化合物NaOH,是含有共价键和离子键的化合物,以氢氧化钠溶液作为电解质溶液,Al棒与铁棒分别作为电极构成原电池,则活泼金属铝为负极,发生失电子的氧化反应,该电极反应式为:Al-3e
-+4OH
-=AlO
2-+2H
2O,以铁棒为电极,NaOH溶液为电解液构成电解池,则阴极是氢离子发生得电子得还原反应,该电极反应为:2H
++2e
-=H
2↑,故答案为:离子键、共价键;Al-3e
-+4OH
-=AlO
2-+2H
2O;2H
++2e
-=H
2↑;
(3)①氮气和氢气在工业上可以合成氨,即N
2+3H
2
2NH
3,有利于提高氮气的转化率的措施是能使化学平衡正向移动的方法,可以加入氢气,增大压强,及时的将氨气移走,故答案为:AD;
②甲、乙两个固定体积的容器,在相同的体积和温度下,甲中充入2molBA
3和乙中充入1mol B
2和3molA
2,反应达到平衡时是等效的,所以氮气和氢气合成氨气的焓变数值是两种情况下的热效应数值之和,反应是放热反应,即热化学方程式为N
2(g)+3H
2(g)

2NH
3(g),△H=-(Q
1+Q
2)kJ/mol,故答案为:N
2(g)+3H
2(g)

2NH
3(g),△H=-(Q
1+Q
2)kJ/mol;
③甲、乙两个体积和温度相同的容器,甲中充入2mol BA
3,乙中充入1mol B
2和3mol A
2,甲容器维持温度和体积不变,乙容器维持温度和压强不变,则相当于乙装置是在甲装置的基础上加压,加大压强会使化学平衡向着正反应方向移动,所以氨气的体积分数增大,故答案为:<;乙容器中压强大,生成氨气的过程进行的程度大,因而氨气的体积分数高;
(4)化合物甲、乙都由H、N、O三种元素组成,甲为弱碱即为NH
3?H
2O,乙为强酸,即为HNO
3,
①若硝酸溶液的pH=a,据Kw=C(H
+)?c(OH
-),则溶液中水电离产生的C
(H+)=c
(OH-)=

=10
a-14mol/L,故答案为:10
a-14mol/L;
②两溶液等体积混合后,发生反应生成硝酸铵,铵根离子水解导致溶液显示酸性,则混合溶液中的离子浓度由大到小的顺序是c(NH
4+)>c(NO
3-)>c(OH
-)>c(H
+),故答案为:c(NH
4+)>c(NO
3-)>c(OH
-)>c(H
+);
(5)过氧化钠具有氧化性,能将CN
-氧化为氮气,可用来净水,杀菌消毒,原理方程式为:5Na
2O
2+2CN
-+12H
+=2CO
2↑+N
2↑+10Na
++6H
2O,故答案为:5Na
2O
2+2CN
-+12H
+=2CO
2↑+N
2↑+10Na
++6H
2O.
点评:本题是一道考查学生所学综合知识的题目,要求学生具有分析和解决问题的能力,难度大.

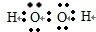 ,故答案为:
,故答案为: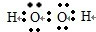 ;
; 2NH3,有利于提高氮气的转化率的措施是能使化学平衡正向移动的方法,可以加入氢气,增大压强,及时的将氨气移走,故答案为:AD;
2NH3,有利于提高氮气的转化率的措施是能使化学平衡正向移动的方法,可以加入氢气,增大压强,及时的将氨气移走,故答案为:AD; 2NH3(g),△H=-(Q1+Q2)kJ/mol,故答案为:N2(g)+3H2(g)
2NH3(g),△H=-(Q1+Q2)kJ/mol,故答案为:N2(g)+3H2(g) 2NH3(g),△H=-(Q1+Q2)kJ/mol;
2NH3(g),△H=-(Q1+Q2)kJ/mol; =10a-14mol/L,故答案为:10a-14mol/L;
=10a-14mol/L,故答案为:10a-14mol/L;

 综合自测系列答案
综合自测系列答案








