
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
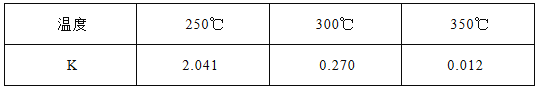
①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。
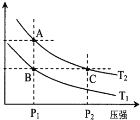
【答案】(1) ①<;低温② d f ;(2)<;=;升温
【解析】
试题分析:(1) ①由于该反应是气体分子数减小的反应,因此是熵减反应,故熵变△S<0;由于升高温度,平衡常数减小,化学平衡逆向移动,因此该反应正向放热,即△H<0,根据复合判据△G=△H-T△S<0时,反应自发进行,因此该反应在低温条件下能自发进行;②a.由于该反应是放热反应,因此升温平衡逆向移动,CO的转化率降低,a错误;b.加入催化剂能提高反应速率,但是平衡不移动,不能提高CO的转化率,b错误;c.增加CO的浓度平衡正向移动,H2的转化率提高,而CO自身的转化率降低,c错误;d.加入H2加压,平衡正向移动,CO的转化率增大,d正确;e.加入惰性气体加压,由于容器体积不变,因此各物质浓度不变,平衡不移动,不能提高CO的转化率,e错误;f.分离出甲醇,使平衡不断正向移动,CO的转化率增大,f正确;故答案d、f;(2)温度相同时,增大压强,反应速率增大,因此,反应速率,A<C;由于A、C两点的温度相同,因此平衡常数相等,即平衡常数A=C;由状态B到状态A,压强不变,H2的体积分数增大,证明平衡逆向移动,由于该反应逆向吸热,因此可采用升温的方法。


科目:高中化学 来源: 题型:
【题目】下列电离方程式的书写错误的是 ( )。
A.BaCl2=Ba2++Cl-B.Na2CO3=2Na++CO32-
C.MgCl2=Mg2++2Cl-D.Ba(OH)2=Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
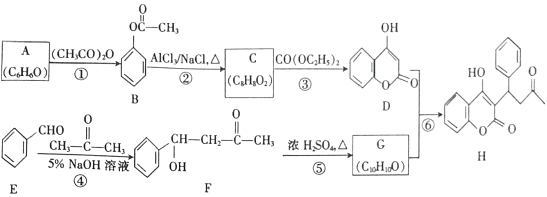
【题目】苄丙酮香豆素(H)常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。
已知: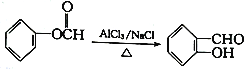
回答下列问题:
(1)A的名称是_________,H 中含氧官能团的名称是_________ 。
(2)反应①的反应类型是_________,反应④的反应类型是_________ 。
(3)C 的结构简式为_________ 。
(4)反应⑤的化学方程式为_________ 。
(5)F 的同分异构体中,满足下列条件的有_____种,其中核磁共振氢谱有7组峰,且峰面积之比为1:2:2:2:2:1:2的结构简式为__________。(任写一种)
①分子结构中除苯环外不含其他环,且不含甲基
②能和FeCl3溶液发生显色反应
③1mol该有机物能与2molNaOH 恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料(其他无机试剂任选)制备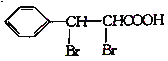 的合成路线。_____________
的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO(g)+O2(g)![]() 2NO2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是( )
2NO2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是( )
A.单位时间内生成n mol O2的同时生成n mol NO2
B.混合气体的颜色不再改变的状态
C.ν(NO2):ν(NO):ν(O2)=2:2:1的状态
D.混合气体的密度不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a> c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
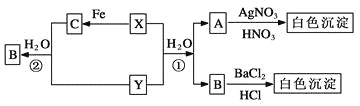
试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某化学兴趣小组将无水三草酸合铁酸钾按如图所示装置进行实验。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
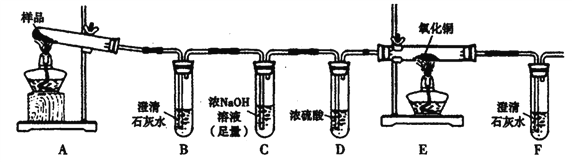
限选试剂:浓硫酸、1.0mol/L HNO3、1.0mol/L盐酸、1.0 mol/L NaOH.3% H2O2、0.1 mol/LKI、0.1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
I.若实验中,观察到B、F中溶液均变浑浊,则E中的现象是____,推测三草酸合铁酸钾分解的气体产物是____。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设:假设l____;假设2____;假设3____。
(2)设计实验方案并验证
①取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
②取少量上述不溶固体放入试管中,加入足量____溶液,充分振荡。若溶液颜色及加入的不溶固体无明显变化,则假设____成立。若溶液颜色明显改变,且有暗红色固体生成,则证明有____存在。
③取②所得暗红色固体于试管中,滴加过量____,振荡后静置。取上层清液于试管中,滴加适量____,再滴加____,若溶液基本无色,则假设____成立;若溶液呈____,则假设_____成立。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水。
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10-13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
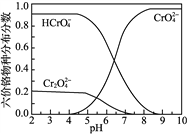
③六价铬在溶液中物种分布分数与pH关系如右图所示。
④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成。
(1)实验时需要配制100 mL 3mol·L-1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要的玻璃仪器是________。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是________。
(3) “氧化”时H2O2滴加速度不宜过快,其原因是____________________________;“氧化”时发生反应的离子方程式为__________________________________________________。
(4) “煮沸”的目的是________。
(5) 请设计用“冷却液”制备PbCrO4的实验方案:________[实验中须使用的试剂有:6 mol·L-1的醋酸, 0.5 mol·L-1Pb(NO3)2溶液, pH试纸]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com