
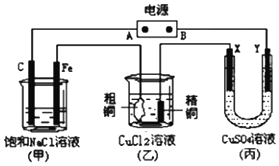
 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:分析 甲为电解饱和食盐水,向甲中滴入酚酞试液,在Fe极附近显红色,说明该极上氢离子放电,所以该电极是阴极,C电极是阳极,阳极与电源正极相连,则A是电源的正极,B是原电池的负极,乙中是精炼铜,粗铜作阳极,精铜作阴极,丙中X电极是阳极,Y是阴极,串联电路中转移的电子的物质的量相等,据此解答.
解答 解:(1)甲为电解饱和食盐水,在Fe极附近显红色,说明该极上氢离子放电,氢氧根浓度大于氢离子浓度,溶液呈碱性,所以该电极是阴极,C电极是阳极,阳极与电源正极相连,则A是电源的正极,B是原电池的负极,故答案为:负极;
(2)在甲中,石墨电极为阳极,阳极上氯离子失去电子发生氧化反应生成氯气,阴极上氢离子得到电子发生还原反应生成氢气,溶液中氢氧根浓度增大,生成碱,电池总反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:氧化;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)如果乙装置中精铜电极的质量增加了0.64g,电极反应为:Cu2++2e-=Cu,则转移电子为0.02mol,电路中电子转移守恒,甲中铁电极的反应:2H++2e-=H2↑,则在标况下产生氢气的体积为:0.01mol×22.4L/mol=0.224L,故答案为:0.224;
(4)在丙装置中,X为阳极,阳极上氢氧根离子失去电子发生氧化反应生成氧气,电极反应式为:2H2O-4e-=4H++O2↑ 或4OH--4e-=2H2O+O2↑,
故答案为:2H2O-4e-=4H++O2↑ 或4OH--4e-=2H2O+O2↑;
(5)丙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙池产生精铜的电极反应为:Cu2++2e-=Cu,则精铜增重:$\frac{1.2mol}{2}×64g/mol$=38.4g,
故答案为:38.4.
点评 本题考查了电解原理,准确判断电极是解本题的关键,注意根据串联电路中转移的电子的物质的量相等结合电极方程式计算分析,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;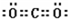 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
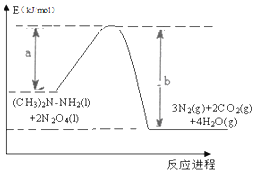 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.93g | B. | 3.51g | C. | 4.00g | D. | 5.85g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol | B. | 5.5 mol | C. | 3 mol | D. | 2.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com