
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
【知识点】溶液中的离子浓度关系 H3 H6
【答案解析】D 解析:A、0.1mol·L-1的(NH4)2CO3溶液中:c(NH4+)>c(CO32-),故A错误;B、0.1 mol·L-1的NaHCO3溶液中,根据物料守恒:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;C、根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;D、根据质子守恒,溶液中水电离产生的氢氧根离子浓度一定等于水电离产生的氢离子浓度,故D正确。
故答案选D
【思路点拨】本题考查了溶液中的离子浓度关系,关键是理解并灵活应用电荷守恒、物料守恒、质子守恒。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
高分子材料M的合成路线如图所示:
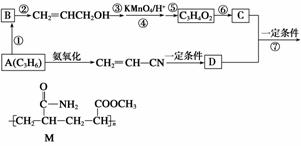
请回答下列问题:
(1)写出A的结构简式:______________;B的结构简式为____________,名称(系统命名)为____________。
(2)写出反应类型:反应⑥________________________,反应⑦____________。
(3)写出反应条件:反应②________________________,反应⑤____________。
(4)反应③和⑤的目的是________________________。
(5)写出D在NaOH溶液中水解的化学方程式:__________________。
(6)写出M在碱性条件下水解的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表面上镀有金属保护层的铁板,当镀层损坏使铁板裸露后,在相同条件下最耐腐蚀的是( )
A.镀锌铁板(白铁) B.镀锡铁板(马口铁)
C.镀银铁板 D.镀铜铁板
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
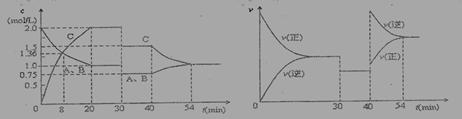
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A、若a=b,则c(NH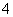 )=c(Cl-) B、若a>b,则c(NH
)=c(Cl-) B、若a>b,则c(NH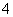 )>c(Cl-)
)>c(Cl-)
C、若a>b,则c(OH-)>c(H+) D、若a<b,则c(OH-)<c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是( )
A.c(CO32—)>c(H2CO3)
B.c(Na+)>c(HCO3—)>c(OH—)>c(H+)
C.c(Na+)+c(H+)=c(HCO3—)+c(CO32—)+c(OH—)
D.c(Na+)=c(HCO3—)+c(CO32—)
查看答案和解析>>
科目:高中化学 来源: 题型:
按一定的分类方法可将浓硫酸、无水氯化钙、固体氢氧化钠等物质归于同一类物质。现有X物质亦可归于此类物质,但X与固体氢氧化钠有更多相似的性质。则X应该是( )
A.KOH溶液
B.无水硫酸铜
C.氧化钙
D.硝酸钾固体
查看答案和解析>>
科目:高中化学 来源: 题型:
不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学的原则,实现原料和过程的绿色化。下列实验或实验过程遵循绿色化学原则的是( )
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜与浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
④用双氧水代替高锰酸钾制氧气
⑤将用铜粉与浓硫酸反应制取硫酸铜的实验方案改为先将铜粉在空气中充分加热制得氧化铜,再将氧化铜溶解在稀硫酸中
A.①② B.②③ C.③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
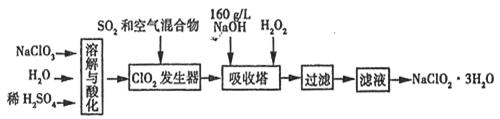
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com