
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
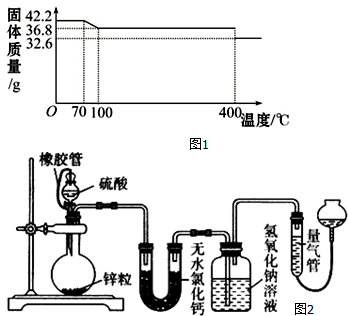
分析 (1)42.2g K4[Fe(CN)6]•3H2O的物质的量为0.1mol,含有结晶水质量为0.1mol×3×18g/mol=5.4g,而150℃时固体物质的质量为36.8g,质量减少为42.2g-36.8g=5.4g,故150℃完全失去结晶水;
(2)发生反应:KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性);
HCN?H++CN-的电离平衡常数Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$,溶液呈中性,则c(H+)=c(OH-)=10-7 mol/L,由电荷守恒c(H+)+c(K+)=c(CN-)+c(Cl-)+c(OH-),故c(K+)=c(CN-)+c(Cl-),则c(CN-)=(0.5a-0.005)mol/L,根据物料守恒c(HCN)=0.5amol/L-c(CN-)=0.005mol/L,代入电离平衡常数表达式计算;
(3)催化剂的特点,恢复原来状态,则Fe3+→Fe2+,故Fe3+将SO2氧化为硫酸;
(4)(I)氢氧化钠溶液吸收二氧化硫,根据Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算生成二氧化硫消耗硫酸物质的量,计算与Zn反应生成氢气的硫酸物质的量,根据Zn+H2SO4=ZnSO4+H2↑计算生成氢气;
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,测定二氧化硫的质量偏大;
(Ⅱ)构成锌铜--硫酸原电池,加快反应速率;
(Ⅲ)①Zn过量,探究硫酸铜的量对氢气生成速率的影响,应使每组实验最终溶液中硫酸的浓度一致,可取同量的硫酸,而硫酸铜和水的体积之和相同;
②根据生成相同体积的氢气所需时间可以判断反应速率.
解答 解:(1)42.2g K4[Fe(CN)6]•3H2O的物质的量为0.1mol,含有结晶水质量为0.1mol×3×18g/mol=5.4g,而150℃时固体物质的质量为36.8g,质量减少为42.2g-36.8g=5.4g,故150℃完全失去结晶水,则150℃时固体物质的化学式为:K4[Fe(CN)6],
故答案为:K4[Fe(CN)6];
(2)发生反应:KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN?H++CN-的电离平衡常数Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$,溶液呈中性,则c(H+)=c(OH-)=10-7 mol/L,由电荷守恒c(H+)+c(K+)=c(CN-)+c(Cl-)+c(OH-),故c(K+)=c(CN-)+c(Cl-),则c(CN-)=(0.5a-0.005)mol/L,根据物料守恒c(HCN)=0.5amol/L-c(CN-)=0.005mol/L,则Ka=$\frac{c({H}^{+})×c(C{N}^{-})}{c(HCN)}$=$\frac{1{0}^{-7}×(0.5a-0.005)}{0.005}$mol•L-1 =(100a-1)×10-7 mol•L-1
故答案为:>;(100a-1)×10-7 mol•L-1;
(3)催化剂的特点,恢复原来状态,则Fe3+→Fe2+,故Fe3+将SO2氧化为硫酸,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)(I)氢氧化钠溶液吸收二氧化硫,则生成二氧化硫为$\frac{m}{64}$mol,
由Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,消耗硫酸为$\frac{m}{32}$mol,
则生成氢气的硫酸为cV mol-$\frac{m}{32}$mol=(cV-$\frac{m}{32}$)mol,
根据Zn+H2SO4=ZnSO4+H2↑可知,生成氢气体为(cV-$\frac{m}{32}$)mol,
若撤走盛有无水氯化钙的U型管,混合气体中的水蒸气进入氢氧化钠溶液,导致洗气瓶增重量增大,测定二氧化硫的质量偏大,则生成氢气物质的量偏小,n(SO2):n(H2)的数值将偏大,
故答案为:(cV-$\frac{m}{32}$)mol;偏大;
(Ⅱ)Zn置换出Cu,形成Zn|H2SO4(aq)|Cu原电池,从而使反应速率加快,
故答案为:锌和铜构成原电池,加快反应速率;
(Ⅲ)①Zn过量,探究硫酸铜的量对氢气生成速率的影响,应使每组实验最终溶液中硫酸的浓度一致,可取同量的硫酸,而硫酸铜和水的体积之和相同,即V1=V2=V3=V4=40,由E组可知酸铜和水的体积之和为10 mL,所以V5=5、V7=9,
故答案为:5;9;
②根据生成相同体积的氢气所需时间可以判断反应速率,为探究氢气生成速率要收集产生的气体,还需记录:收集等体积气体所需时间,
故答案为:收集等体积气体所需时间.
点评 本题考查反应速率探究实验、化学方程式计算、弱电解质电离等,是对学生综合能力的考查,需要学生具备扎实的基础,注意利用控制变量法进行反应速率影响因素探究,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
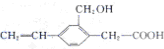
| A. | 该有机化合物的分子式为C11H10O3 | |
| B. | 该有机化合物能发生取代反应、加成反应和加聚反应 | |
| C. | 1mol该有机化合物分别消耗Na、NaOH和NaHCO3的物质的量之比为2:2:1 | |
| D. | 该有机化合物与 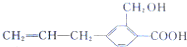 互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com