
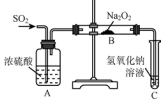
 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:分析 (1)Na2O2与CO2反应,生成碳酸钠和氧气,该反应中过氧化钠失电子作还原剂,得电子作氧化剂,只有过氧化钠中O元素的化合价变化,电子转移数目是2e-,以此来解答;
(2)设计实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3,可将白色固体与硫酸反应,若有亚硫酸钠,则有二氧化硫产生,利用品红检验二氧化硫的存在;
(3)过氧化钠和硝酸都具有强氧化性,都能把亚硫酸根离子氧化成硫酸根离子;
(4)无论是否发生HCl+NaHCO3=NaCl+CO2↑+H2O、CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,反应前后的体积均不变,再通过足量的Na2O2固体,气体体积减小,最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体,说明一定有生成的二氧化碳,且最后剩余气体为氮气,以此来解答.
解答 解:(1)Na2O2与CO2反应,生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为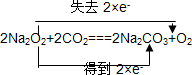 ,
,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;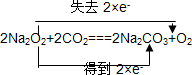 ;
;
(2)Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2;验证白色固体是亚硫酸钠的方法利用亚硫酸钠和酸反应生成的二氧化硫具有漂白性检验,实验步骤为:取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体,所以选择AB,
故答案为:AB;
(3)在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:不合理;稀硝酸能使亚硫酸钡转化为硫酸钡;若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-;
(4)无论是否发生HCl+NaHCO3=NaCl+CO2↑+H2O、CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,反应前后的体积均不变,将混合气体依次通过NaHCO3溶液和灼热的CuO,气体体积无变化,气体若含有CO、HCl在此全部转化为CO2.再通过Na2O2,气体体积明显减小,2Na2O2+2CO2═2Na2CO3+O2,Na2O2一定是吸收前面生成的二氧化碳气体生成氧气,使气体体积明显减小;最后通过灼热的铜网,体积又减少,并有剩余气体,说明一定有N2,则混合气体中一定有N2,可能有HCl、CO中至少含有一种.
故答案为:N2,HCl和CO中至少有一种.
点评 本题以探究过氧化钠与二氧化硫的反应为依托,考查知识的迁移能力、设计和评价实验方案的能力,把握元素化合物性质、发生的反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活字印刷的泥活字是硅酸盐材料制成的 | |
| B. | 制指南针的磁石主要成分是四氧化三铁 | |
| C. | 引爆黑火药后,硫磺燃烧生成三氧化硫 | |
| D. | 用树皮造纸过程主要是提取其中的纤维素 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:实验题
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
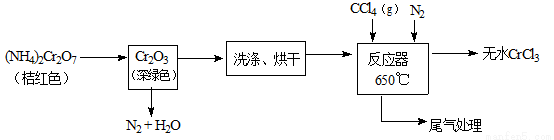
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,应采用的措施是 。
(3)用下图装置制备CrCl3时,主要步骤包括:

①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定:
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为_____________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.由C(石墨)=C(金刚石)ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定
D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com