
| A. | 充电时阳极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 0.1molK2FeO4发生反应,转移电子数约为1.806×1024 | |
| C. | 充电时K2FeO4发生氧化反应 | |
| D. | 放电时正极反应为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH- |
分析 放电时,失电子化合价升高的金属为负极材料,负极反应为:3Zn-6e-+6OH-═3Zn(OH)2,放电时,正极上得电子发生还原反应,电池反应式减去负极电极反应式得到正极电极反应式:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,充电时,阴极上得电子发生还原反应,与原电池负极电极反应相反,阳极上失电子发生氧化反应,与原电池正极电极反应相反,据此解答.
解答 解:A.放电时,正极反应为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,则充电的阳极反应为:2Fe(OH)3+10OH--6e-=2FeO42-+8H2O,故A错误;
B.根据反应关系FeO42-~3e-可知0.1molK2FeO4转移电子数:0.1mol×3=0.3mol,则转移电子数约为:0.3×6.02×1023=1.806×1023,故B错误;
C.放电时,正极K2FeO4发生还原反应,充电时,K2FeO4是氧化产物,故C错误;
D.放电时,正极上得电子发生还原反应,电极反应式为2FeO42-+6e-+8H2O═2Fe(OH)3+10OH-,故D正确;
故选D.
点评 本题考查了化学电源新型电池,根据元素化合价变化确定正负极、阴阳极上发生的反应,知道充电电池中正负极和阳极、阴极电极反应式的关系,难点是电极反应式的书写,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
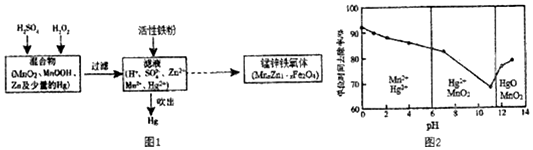
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:Z>X>Y | |
| B. | Z的氢化物的沸点一定比X 的低 | |
| C. | W的最高价氧化物对应水化物的酸性在同主族中最强 | |
| D. | Y的单质与Z、X形成的化合物反应可冶炼金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
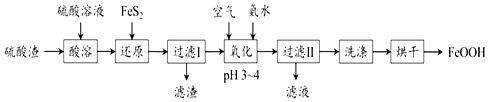
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤I中白色沉淀A的化学式为BaSO4 | |
| B. | 步骤Ⅱ中产生沉淀C的反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 原溶液一定含有:Na+、Fe2+、Al3+、SO42- | |
| D. | CO2先后分别与NaOH(aq)、NaAlO2( aq)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
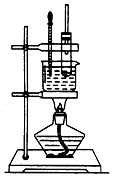 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com