
(14分)(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是_________ __,[Cu(H2O)4]2+名称为 ,画出该配离子中的配位键__________ _______ 。
(2)根据VSEPR预测HCN的空间结构为 形,其中C原子用于形成σ键的是 个 轨道,用于形成π键的是 个 轨道。
(3)根据甲醛的分子结构特点推测俗称光气的二氯甲醛分子(COCl2)结构式为 ,中心原子杂化方式为 ,空间结构为 形。
(4)按要求写出仅由第三周期非金属元素的原子构成且中心原子通过sp3杂化形成分子的化学式(各写一种):
正四面体分子____ _,三角锥形分子____ ____,V形分子___ __ _ ___。
(14分)(1)Fe3+(1分),
四水合铜离子(1分),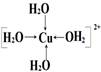 (1分)
(1分)
(2)直线(1分),2(1分),SP杂化(1分),2(1分),未杂化的P轨道(1分)
(3)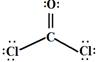 (1分),SP2(1分),平面三角(1分)
(1分),SP2(1分),平面三角(1分)
(4)SiCl4(1分),PCl3(1分),SCl2(1分)
【解析】(1)根据配合物化学式可知,Fe(SCN)2+中提供空轨道接受孤对电子的微粒应该是铁离子;[Cu(H2O)4]2+名称为四水合铜离子,其中水是配体,铁离子提供空轨道,所以该配离子中的配位键是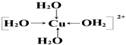 。
。
(2)化合物HCN中中心原子碳原子没有孤对电子,所以该化合物是直线型结构。其中C原子用于形成σ键的是2个sp杂化轨道;而未参与杂化的p轨道电子用于形成π键。
(3)二氯甲醛分子(COCl2)中中心碳原子也没有孤对电子,所以是平面三角形结构,因此是sp2杂化,其结构式是 。
。
(4)仅由第三周期非金属元素的原子构成且中心原子通过sp3杂化形成分子中,如果是正四面体形结构,则应该是SiCl4;如果是三角锥形结构,则应该是PCl3;如果是直线型结构,则应该是SCl2。


科目:高中化学 来源: 题型:
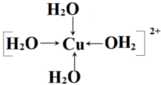

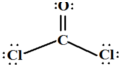

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子![]() 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省巴中市四县中高二上期期末联考化学试卷 题型:填空题
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子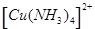 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
科目:高中化学 来源:2013届四川省巴中市四县中高二上期期末联考化学试卷 题型:填空题
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com