
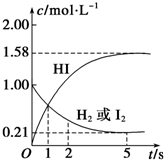
 ijĪĀ¶ČŹ±£¬ĻņijV LµÄĆܱÕČŻĘ÷ÖŠ³äČė3molH2£Øg£©ŗĶ3mol I2£Øg£©£¬·¢Éś·“Ó¦£ŗ
ijĪĀ¶ČŹ±£¬ĻņijV LµÄĆܱÕČŻĘ÷ÖŠ³äČė3molH2£Øg£©ŗĶ3mol I2£Øg£©£¬·¢Éś·“Ó¦£ŗ·ÖĪö £Ø1£©øł¾ŻV=$\frac{n}{c}$¼ĘĖć£»
£Ø2£©øł¾Ż»ÆŃ§Ę½ŗāדĢ¬ĢŲÕ÷£¬Ę½ŗāŹ±ø÷ĪļÖŹÅØ¶Č²»ŌŁøı䣻øł¾ŻĖŁĀŹv=$\frac{”÷c}{”÷t}$¼ĘĖć£»
£Ø3£©øł¾ŻÉś³ÉĪļŗĶ·“Ó¦ČČÖ®¼äµÄ¹ŲĻµŹ½¼ĘĖćČČĮ森
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĶ¼ĻóæÉÖŖ£¬ĒāĘųŗĶµā³õŹ¼ĪļÖŹµÄĮæÅضČĪŖ1mol/L£¬ĖłŅŌČŻĘ÷µÄĢå»żV=$\frac{3mol}{1mol/L}$=3L£»
¹Ź“š°øĪŖ£ŗ3
£Ø2£©æÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬ŹĒø÷ĪļÖŹµÄÅØ¶Č²»ŌŁøı䣬øł¾ŻĶ¼Ļó£¬øĆ·“Ó¦ŌŚ5sŹ±“ļµ½Ę½ŗāדĢ¬£»“Ó·“Ó¦æŖŹ¼µ½øĆ·“Ó¦“ļµ½×ī“óĻŽ¶ČŹ±£¬øĆŹ±¶ĪÄŚĘ½¾ł·“Ó¦ĖŁĀŹv£ØHI£©=$\frac{1.58mol/L}{5s}$=0.316mol/£ØL£®s£©£»
¹Ź“š°øĪŖ£ŗ5£»0.316
£Ø3£©ÓÉĢāæÉÖŖ·“Ó¦1molĒāĘų·ÅČČ26.5kJČČĮ棬²ĪÓė·“Ó¦µÄĒāĘųĪŖ3mol-£Ø0.21mol”Į3L£©=2.37mol£¬Ōņ·Å³öµÄČČĮæĪŖ£»2.37mol”Į26.5kJ=62.8kJ£»
¹Ź“š°øĪŖ£ŗ62.8£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹ¼ĘĖć”¢»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶ĻµČÖŖŹ¶µć£¬²ąÖŲæ¼²é·ÖĪö¼ĘĖćÄÜĮ¦£¬Ö»ÓŠ·“Ó¦Ē°ŗóøıäµÄĪļĄķĮæ²ÅÄÜ×÷ĪŖ»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶ĻŅĄ¾Ż£¬ĢāÄæÄŃ¶Č²»“ó



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.5£Øb-2a£©mol/L | B£® | 5£Øb-2a£©mol/L | C£® | 0.5£Øb-a£©mol/L | D£® | 10£Øb-2a£©mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
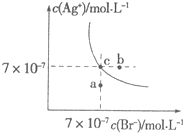 ŌŚt”ꏱ£¬AgBrŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£®ÓÖÖŖt”ꏱAgClµÄKsp=4”Į10-10£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ŌŚt”ꏱ£¬AgBrŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£®ÓÖÖŖt”ꏱAgClµÄKsp=4”Į10-10£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ŌŚt”ꏱ£¬AgBrµÄKspĪŖ4.9”Į10-13 | |
| B£® | ŌŚAgBr±„ŗĶČÜŅŗÖŠ¼ÓČėNaBr¹ĢĢ壬æÉŹ¹ČÜŅŗÓÉcµćµ½bµć | |
| C£® | Ķ¼ÖŠaµć¶ŌÓ¦µÄŹĒAgBrµÄ²»±„ŗĶČÜŅŗ | |
| D£® | Ļņ×é³ÉĪŖcµćµÄČÜŅŗÖŠ¼ÓČėµČĢå»żµÄ0.1 mol/LµÄĀČ»ÆÄĘČÜŅŗ£¬æɲśÉśAgCl³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
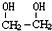 £©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬
£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ £Øg£©”÷H=a kJ/mol
£Øg£©”÷H=a kJ/mol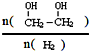 Ōö“óµÄ“ėŹ©ÓŠ½µĪĀ”¢¼ÓŃ¹”¢Ōö¼ÓCOµÄÅØ¶Č»ņ¼°Ź±½«ŅŅ¶ž“¼“Ó»ģŗĻĪļÖŠ·ÖĄė³öĄ“£ØŠ“Į½Ģõ£©
Ōö“óµÄ“ėŹ©ÓŠ½µĪĀ”¢¼ÓŃ¹”¢Ōö¼ÓCOµÄÅØ¶Č»ņ¼°Ź±½«ŅŅ¶ž“¼“Ó»ģŗĻĪļÖŠ·ÖĄė³öĄ“£ØŠ“Į½Ģõ£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗćĪĀŗćČŻ£¬³äČėNO2ĘųĢ壬Ęä×Ŗ»ÆĀŹŌö“ó | |
| B£® | ¼ÓŃ¹£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬»ģŗĻĘųĢåŃÕÉ«±äÉī | |
| C£® | ČōĘ½ŗā³£ŹżŌö“ó£¬ŌņæÉÄÜŹĒÉżøßĮĖĪĀ¶Č»ņ¼õŠ”ĮĖĢåĻµµÄŃ¹Ēæ | |
| D£® | µ±2vÕż£ØNO£©=vÄę£ØO2£©Ź±£¬·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com