
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A NH4Cl为强酸弱碱盐 用加热法除去NaCl中的NH4Cl
B Fe3+具有氧化性 用KSCN溶液可以鉴别Fe3+
C 溶解度:CaCO3<Ca(HCO3)2 溶解度:Na2CO3<NaHCO3
D SiO2可与HF反应 氢氟酸不能保存在玻璃瓶中
A. A B. B C. C D. D
考点: 铵盐;硅和二氧化硅;二价Fe离子和三价Fe离子的检验.
专题: 氮族元素;碳族元素;几种重要的金属及其化合物.
分析: A.氯化铵是强酸弱碱盐,且不稳定;
B.铁离子具有氧化性,能氧化还原性物质,铁离子和硫氰根离子反应生成血红色硫氰化铁溶液;
C.碳酸钙的溶解度小于碳酸氢钙,但碳酸钠的溶解度大于碳酸氢钠;
D.二氧化硅是酸性氧化物,但能和氢氟酸反应.
解答: 解:A.氯化铵是强酸弱碱盐,其水溶液呈酸性,氯化铵不稳定,加热易分解,两者没有因果关系,故A错误;
B.铁离子具有氧化性,能氧化还原性物质,铁离子和硫氰根离子反应生成血红色硫氰化铁溶液,可以用硫氰化钾溶液检验铁离子,两者没有因果关系,故B错误;
C.碳酸钙的溶解度小于碳酸氢钙,但碳酸钠的溶解度大于碳酸氢钠,二者没有因果关系,故C错误;
D.二氧化硅能和氢氟酸反应,玻璃中含有二氧化硅,所以玻璃瓶不能保存氢氟酸,二者有因果关系,故D正确;
故选D.
点评: 本题考查较综合,明确二氧化硅的性质,铁离子的检验是高考热点,应熟练掌握.


科目:高中化学 来源: 题型:
温时,M(OH)2(s)⇌M2+(aq)+2OH﹣(aq)Ksp=a,c(M2+)=b mol•L﹣1时,溶液的pH等于( )
|
| A. |
| B. |
| C. | 14+ | D. | 14+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 只有活泼金属与活泼非金属元素原子之间才能形成离子键
B. Na2O2中阳离子和阴离子个数比为1:1
C. 形成离子键的阴、阳离子间只有静电吸引力
D. 共价键存在于共价化合物中,也可能存在于单质及离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4 B. 1:5 C. 2:3 D. 2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
汞(熔点﹣39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如下.

下列分析错误的是( )
A. “灼烧辰砂法”过程中电子转移的方向和数目可表示为: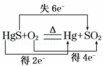
B. 辰砂与氧化钙加热反应时,CaSO4为氧化产物
C. 洗涤粗汞可用5%的盐酸代替5%的硝酸
D. 减压蒸馏的目的是降低汞的沸点,提高分离效率
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
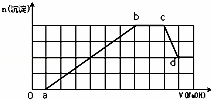
A. d点溶液中含有的溶质只有Na2SO4
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
C. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
D. 原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中,不能用勒沙特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com