
| A. | 离子半径:S2->O2->Na+>Al3+ | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 电负性:F>O>N>C | D. | 第一电离能:F>O>N>C |
分析 A、电子层数越少,半径越小,核外电子排布相同的离子,核电荷数越大,离子半径越小;
B、元素的非金属性越强,对应的氢化物越稳定;
C、得电子能力越强,电负性越大;
D.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素.
解答 解:A、S2-是三个电子层,而O2-、Na+、Al3+核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径:S2->O2->Na+>Al3+,故A正确;
B、非金属性Cl>S>P>As,元素的非金属性越强,对应的氢化物越稳定,所以热稳定性:HCl>H2S>PH3>AsH3,故B正确;
C、得电子能力F>O>N>C,所以电负性是:F>O>N>C,故C正确;
D.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:F>N>O>C,故D错误;
故选D.
点评 本题考查学生元素周期律的知识,可以根据所学知识来回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐类的水解过程是中和反应的逆过程,是吸热过程 | |
| B. | 易水解的盐溶于水后,都抑制了水的电离 | |
| C. | 易水解的盐溶液中,水电离出的以游离态存在的H+和OH-的浓度永远相等 | |
| D. | 易水解的盐溶液肯定不是中性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物的密度随着相对分子质量增大逐渐增大 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应,它们燃烧时生成二氧化碳和水 | |
| D. | 烷烃同系物都能使溴水、KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;
.写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;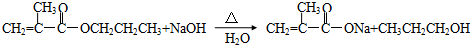 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
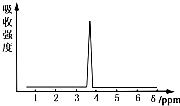 在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com