
【题目】工业上制硝酸的主要反应是4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度,K值______(填“增大”或“减小”或 “不变”);升高温度,化学反应速率将______(填“增大”或“减小” 或 “不变”)。
(2)若反应物起始的物质的量相同,下列关系图正确的是______(填序号)。

(3)若达到平衡状态后升高温度则正反应速率和逆反应速率___________________ 。(填“同时增大”或“逆反应速率增大,正反应速率不变”)
(4)工业上合成氨气的反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
2NH3(g)ΔH<0 ,在密闭容器中反应达到平衡状态的标志是_______。
①压强不再改变
②生成氨气的速率等于生成氮气的速率
③正反应速率等于零
④容器内气体的平均相对分子量不再改变
⑤单位时间内有3amolH-H的断裂的同时有6amolN-H断裂
【答案】c4(NO)c6(H2O)/c4(NH3)c5(O2) 减小 增大 abd 同时增大 ①④⑤
【解析】
(1)依据化学方程式,结合平衡常数概念列式得到;反应是放热反应,升温,平衡逆向进行;
(2)A、该反应是放热反应,升温,平衡逆向移动,温度升高NO含量减小;
B、增大压强,平衡逆向移动,一氧化氮含量减小;
C、该反应是放热反应,升温,平衡逆向移动,温度升高NO含量减小;
D、催化剂降低反应活化能,改变反应速率,缩短达到平衡需要的时间,但不能改变平衡移动方向;
(3)若达到平衡状态后升高温度,正逆反应速率均增大;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变。
(1)依据反应化学方程式,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),可知平衡常数K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,故答案为:c4(NO)c6(H2O)/c4(NH3)c5(O2);
4NO(g)+6H2O(g),可知平衡常数K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,故答案为:c4(NO)c6(H2O)/c4(NH3)c5(O2);
(2)升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向吸热反应方向移动,NO含量减小,故a正确;增大压强,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向气体体积逆反应方向移动,则NO含量减少,故b正确;升高温度,正逆反应速率都增大,反应达到平衡的时间缩短,平衡向逆反应方向移动,NO含量减小,故c错误;使用催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,则NO含量减小不变,故d正确,选abd,故答案为:abd;
(3)升高温度,正逆反应速率都增大,故答案为:同时增大;
(4)①反应前后气体的物质的量不相等,当容器内压强不再改变,说明达到平衡状态,正确;
②生成氨气的速率为正反应速率,生成氮气的速率为逆反应速率,当生成氨气的速率等于生成氮气的速率的两倍,说明达到平衡状态,错误;
③该反应为可逆反应,正反应速率不可能等于零,错误;
④根据质量守恒,反应前后混合物的质量不变,反应前后气体的物质的量不相等,当容器内平均相对分子量不再改变,说明达到平衡状态,正确;
⑤单位时间内有3amolH-H的断裂的同时有6amolN-H断裂,说明正逆反应速率相等,说明达到平衡状态,正确。
故答案为:①④⑤


科目:高中化学 来源: 题型:
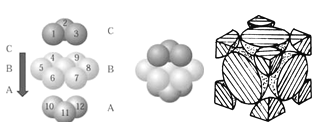
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se______As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____,若晶胞参数为a pm,阿伏加德罗常数的值用NA表示,若晶体密度为_______g·cm﹣3。(列出表达式)。

(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室电解饱和食盐水的装置图。已知,B处产生的气体用小试管收集后点燃有爆鸣声。试回答下列问题:

(1)电解饱和食盐水的化学方程式:_________。
(2)写出电极的名称:C_____。
(3)检验A处气体的方法是______(请问文字叙述)。
(4)____(填“C”或“D”)处附近能看到溶液变红。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:

(1)两种物质都是氧化物的是____(填分类标准代号),写出酸性氧化物与少量NaOH溶液反应的化学方程式____。
(2)分类标准代号A表示___(多项选择)。
a.两物质都是非电解质
b.两物质都是有机物
c.两物质都是含碳化合物
d.两物质都是氧化物
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的化学方程式为____。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为___,该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X + Y ![]() 2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 上述可逆反应的正反应为吸热反应
B. X、Y、Z均为气态
C. X和Y是气态,Z为固态
D. 上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA为阿伏加德罗常数的值)
A. O2-的电子式为![]() ,则O2-核外有8个电子
,则O2-核外有8个电子
B. 1mol NH4Cl中含有的H-Cl键的数目为NA
C. CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在两个过氧键
D. 20gNa2O和Na2O2的混合物中,所含阴阳离子数目之比无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
C.向氯水中加CaCO3后,溶液漂白性增强
D.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com