
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
(1)K= < = (2)0.001 (3)B (4)25%
< = (2)0.001 (3)B (4)25%
【解析】
试题分析:N2O4(g)?2NO2(g),反应的平衡常数K= ;20s时c(NO2)=0.060mol/L N2O4?2 NO2,浓度变化 0.030mol 0.060mol/Lc1=0.10mol/L-0.03mol/L=0.070mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4?2 NO2,浓度变化:(0.1-0.05)mol/L 0.10mol/L所以c2=0.10mol/L所以c2>c1;答案为:K=
;20s时c(NO2)=0.060mol/L N2O4?2 NO2,浓度变化 0.030mol 0.060mol/Lc1=0.10mol/L-0.03mol/L=0.070mol/L;由表可知,40s时,c(N2O4)=0.050mol/L,N2O4?2 NO2,浓度变化:(0.1-0.05)mol/L 0.10mol/L所以c2=0.10mol/L所以c2>c1;答案为:K= < =;(2)(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,N2O4?2 NO2,浓度变化:0.06mol/L 0.120mol/L,V(N2O4)=
< =;(2)(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,N2O4?2 NO2,浓度变化:0.06mol/L 0.120mol/L,V(N2O4)=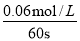 =0.001mol/(L?s);故答案为:0.001;(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确; C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误; D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;故选B;(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
=0.001mol/(L?s);故答案为:0.001;(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;A、增大容器体积,各组分浓度均减小,故A错误;B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确; C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误; D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;故选B;(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12 平衡常数K=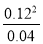 =
=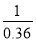
2 NO2 = N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x K=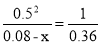 x=0.020mol/L
x=0.020mol/L
则达到平衡时N02气体的转化率 =25%
=25%
考点:化学平衡常数的简单计算


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列有关氧化还原反应的说法正确的是
A.2Na2O2+2H2O=4NaOH+O2? 反应中,Na2O2是氧化剂,H2O是还原剂
B.KClO3+6HCl=KCl+3Cl2?+3H2O 反应中,被氧化的氯元素与被还原的氯元素质量比为6:1
C.KClO3+6HCl=KCl+3Cl2?+3H2O 反应中,转移的电子数为6e-
D.CaH2+2H2O=Ca(OH)2+2H2? 反应中,Ca(OH)2既不是氧化产物也不是还原产物
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
在工业生产中,降低能耗是重要的节能措施。下列说法不符合生产实际的是:
A.使用恰当的还原剂,可以在较低的温度下把金属从矿石中提取出来;
B.研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到节能效果;
C.制水泥、玻璃等硅酸盐工业需要消耗大量能源,我们应通过降低其产量来节能;
D.利用铝的还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
阿伏加德罗常数约为6.02×1023 mol-1(NA),下列说法正确的是
A.常温常压下,16g O2与16g O3所含的原子数均是NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
C.标准状况下,2.24LCCl4所含原子数为0.5NA
D.标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.卢瑟福提出了带核的原子结构模型
B.地球上大量的氯蕴藏在大海中,因此氯被称为“海洋元素”
C.利用同位素治疗肿瘤证明任何同位素对人都不会造成危害
D.利用焰色反应可以鉴别所有金属元素
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X
C.W>Z>Y>X D.X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
分析下列反应在任何温度下均能自发进行的是
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+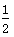 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+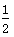 O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)=== 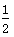 O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol-1
2SO3(g) ΔH=?196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =?113.0 kJ·mol-1
2NO2(g) ΔH =?113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH = kJ·mol-1。
SO3(g)+NO(g)的ΔH = kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
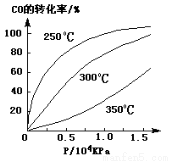
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 mol 甲醇中含有C-H键的数目为4NA
B.0.1mol 丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com