
| A. | 标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA | |
| B. | 2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-a kJ•mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量 | |
| C. | 78gNa2O2固体中含阴离子数目为NA | |
| D. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA |
分析 A、HF溶于水后部分电离;
B、CO2和H2的反应为可逆反应;
C、求出过氧化钠的物质的量,然后根据过氧化钠中含2个阴离子和1个阴离子构成来分析;
D、在双氧水溶液中,除了双氧水外,水也含氧原子.
解答 解:A、HF溶于水后部分电离,故溶液中的HF分子小于NA个,故A错误;
B、CO2和H2的反应为可逆反应,不能进行彻底,故放出的热量小于aKJ,故B错误;
C、78g过氧化钠的物质的量为1mol,而过氧化钠中含2个阴离子和1个阴离子构成,故1mol过氧化钠中含NA个阴离子,故C正确;
D、在双氧水溶液中,除了双氧水外,水也含氧原子,故溶液中的氧原子的个数多于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用25ml酸式滴定管量取21.70 mLKMnO4溶液 | |
| D. | 用托盘天平称量25.20 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 矿物质 | C. | 蛋白质 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
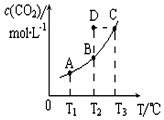 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子的直径在1~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | Fe(OH)3胶体带正电荷,可以产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com