
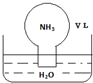
| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$mol |
分析 A.氨气溶于水,溶液体积等于氨气体积;
B.根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
C.根据c=$\frac{1000ρω}{M}$计算溶液的质量分数;
D.根据物料守恒计算,溶液中N元素以NH3•H2O、NH4+形式存在.
解答 解:A.氨气溶于水,水最终会充满整个烧瓶,故A正确;
B.氨气物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,氨气溶于水,溶液体积等于氨气体积,溶液物质的量浓度为$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$ mol•L-1,故B正确;
C.根据c=$\frac{1000ρω}{M}$可知,溶液的质量分数=$\frac{17×\frac{1}{22.4}}{1000ρ}$=$\frac{17}{22400ρ}$,故C错误;
D.溶液中N元素以NH3•H2O、NH4+形式存在,根据物料守恒,所得溶液中n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$mol,故D正确,
故选:C.
点评 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数,注意理解掌握物质的量浓度与质量分数之间关系.


科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
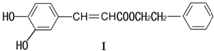
| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
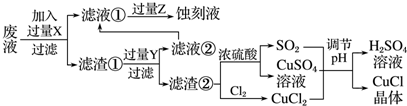
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32- )=1mol•L-1,则溶液中Na+的个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g•(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
 (用化学方程式表示).
(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾天车灯照射的光亮通路属于丁达尔现象 | |
| B. | 二氧化碳、氢氧化物和可吸入颗粒物等是雾霾的主要成分 | |
| C. | 寒冷的冬天,餐桌上的火锅冒出的热气是水蒸气 | |
| D. | 减少户外活动,戴上口罩等是有效应对雾霾天气的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com