
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
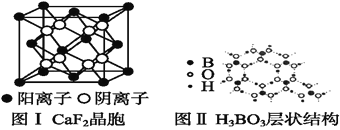
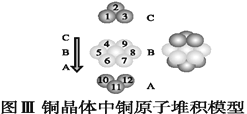
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
【答案】 bd 3CaF2+Al3+=3Ca2++AlF63﹣ V形 sp3 172 低 8 12 O 1∶6 H3BO3 范德华力和氢键
【解析】(1)Ca2+ 与F﹣间存在离子键,离子键是阴阳离子之间的静电作用,包括吸引和排斥,所以选项a错误。离子晶体的熔点一般取决于晶格能的大小,一般来说电荷相等的前提下,离子半径越小,晶格能越大,所以选项b正确。阴阳离子比为2∶1的物质,有的与CaF2晶体构型相同,有的是反CaF2型,例如:Na2O。选项c错误。CaF2中的化学键为离子键,因此CaF2在熔融状态下离子键被破坏,离子能自由移动所以能导电,选项d正确。
(2)CaF2电离的F-可以与Al3+进行配位,从而使CaF2溶解,反应为:3CaF2 + Al3+ = 3Ca2+ + AlF63﹣。
(3)根据价层电子对互斥理论,OF2的中心原子O的价电子对为4,配位数为2,所以O为sp3杂化,分子为V形或者说是折线形。
(4)反应的焓变等于反应物键能减去生成物键能,设ClF3中Cl﹣F键的平均键能为X kJmol﹣1,有:242+3×159-2×3×X=-313,解方程得到X=172。ClF3和BrF3都是分子晶体,熔沸点高低取决于分子间作用力的大小,而结构相似的前提下,分子间作用力的大小可用分子量的大小判断,分子量越大,作用力越大,熔沸点越高。所以熔沸点应该是ClF3小于BrF3。
(5)①以CaF2顶面中心的Ca2+为例,其与下方的4个四个F-以及其上方的另一个晶胞中的四个F-距离最近,所以CaF2晶胞中与Ca2+最近且等距离的F-数为8。图Ⅲ中Cu为ABC型最紧密堆积,所以每个Cu的配位数都是12。
②H原子不可能达到8电子。B的最外层是3个电子,形成3个共价键最外层是6个电子。O形成两个共价键就是8电子结构(图中三个键一个是氢键)。由图示得到H3BO3的结构为B(OH)3通过氢键形成的层状结构,所以1个B对应了3个O-B和3个O-H,即H3BO3晶体中B原子个数与极性键个数比为1:6。
③H3BO3是分子晶体,应该是其中熔点最低的。晶体熔化的时候应该克服的作用力是分子间作用力和氢键。


科目:高中化学 来源: 题型:
【题目】炼铁高炉中发生的基本反应之一为FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0。下列说法错误的是( )
Fe(s)+CO2(g) ΔH>0。下列说法错误的是( )
A. 升高温度,平衡移动后达到新的平衡时平衡常数增大
B. 将高炉加高后,达到平衡时平衡常数增大
C. 将矿石粉碎不能使平衡常数增大
D. 平衡常数越大,尾气中CO含量越少,CO2含量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
⑴工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法 已知:H2S(g) ![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图1。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i S2的结构式为______,该反应的△H_____0(填“>”、“<”或“=”);
ii 计算 985 ℃时H2S按上述反应分解的平衡常数K=________;
iii 比较H2S的速率大小:v(a-逆)______v(b-正) ,v(b-逆)______v(c-正) (填“>”、“<”或“=”);
iiii 说明随温度的升高,曲线b向曲线a逼近的原因:___________;
②电化学法

i该法制氢过程如图2。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为___________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是( )
①. 标准状况下,22.4LSO3中含有的原子数目为4NA
② 在常温常压下,48g 氧气和臭氧的混合气体含氧原子数是3NA
③1molCl2参加反应转移电子数一定为2NA
④ lmolNa2O2 与水充分反应转移的电子数为2NA
⑤ 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA
⑥ 4℃时,22.4 L水中含有的电子数目为 10 NA个
⑦ 使2.3g钠变为 Na+,需失去0.1NA个电子
⑧ 10g46%乙醇水溶液中所含氢原子数目为0.6NA
A. ①②③⑧ B. ②③⑦⑧ C. ②⑦ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】b mL Al2(SO4)3溶液中含有agSO42-,若把此溶液取一半加水稀释至2b mL,则稀释后溶液中Al3+的物质的量浓度为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C内分别充入等质量的X、CO2、Y三种气体,当隔板静止时,A、C内的气体密度相等。下列说法不正确的是

A. 物质的量:n(X)<n(CO2)<n(Y)
B. 分子数目:N(X)=N(Y)
C. 气体的体积:V(X)=V(Y)
D. 摩尔质量:M(X)=M(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氯化钠的晶体结构模型,下列说法不正确的是
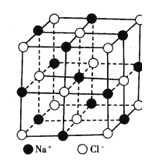
A.NaC1晶体中Na+与C1— 的个数比为1:1
B.每个Na+周围距离最近的C1— 数为6
C.和Na+距离相等且最近的C1— 构成的多面体是正八面体
D.每个Na+周围距离最近的Na+数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Be、Cl、Fe等元素及其化合物有重要的应用。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 (填离子或共价)化合物;根据铍元素和铝元素在周期表中的位置,推测BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(2)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因 。②当然Fe3+也有氧化性,在印刷行业中就用氯化铁溶液腐蚀铜板,写出离子方程式 。
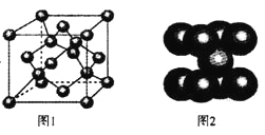
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有________个C原子。
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56gmol-1,该晶体的密度为a gcm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 gB.33 g· mol-1C.32 gD.32 g· mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com